
Physique et Chimie : 2ème Année Bac
Séance 16 (Dosage acido-basique)
Professeur : Mr El GOUFIFA Jihad
Sommaire
I- Principe du dosage acido-basique
1-1/ Définition du dosage
1-2/ Mode opératoire d'un dosage
II- Dosage d'une solution d'acide éthanoïque
2-1/ Expérience
2-2/ Équation de la réaction du dosage
2-3/ Détermination du point d'équivalence
2-4/ Relation d'équivalence
2-5/ Détermination du taux d'avancement final de la réaction
III- Dosage d'une solution d'ammoniaque
3-1/ Expérience
3-2/ Équation de la réaction du dosage
3-3/ Détermination du point d'équivalence
3-4/ Relation d'équivalence
IV- Exercices
4-1/ Exercice 1
4-2/ Exercice 2
4-3/ Exercice 3
4-4/ Exercice 4
I- Principe du dosage acido-basique
1-1/ Définition du dosage
Le dosage (ou titrage) consiste à déterminer la concentration d'une espèce chimique présente dans une solution dite solution titrée en faisant réagir cette solution avec une solution de concentration connue dite solution titrante.
La réaction du dosage doit être rapide, totale et unique, c'est dire que l'état final du système doit être atteint dans une courte durée et le réactif limitant est toujours entièrement consommé et la réaction ne doit pas être en compétition avec d'autres réactions.
I- Principe du dosage acido-basique
1-2/ Mode opératoire d'un dosage
On introduit dans un bécher à l'aide d'une pissette jaugée un volume de la solution à titrer, puis on lui ajoute progressivement à l'aide d'une burette la solution titrante tout en utilisant un système d'agitation afin d'homogénéiser le mélange.
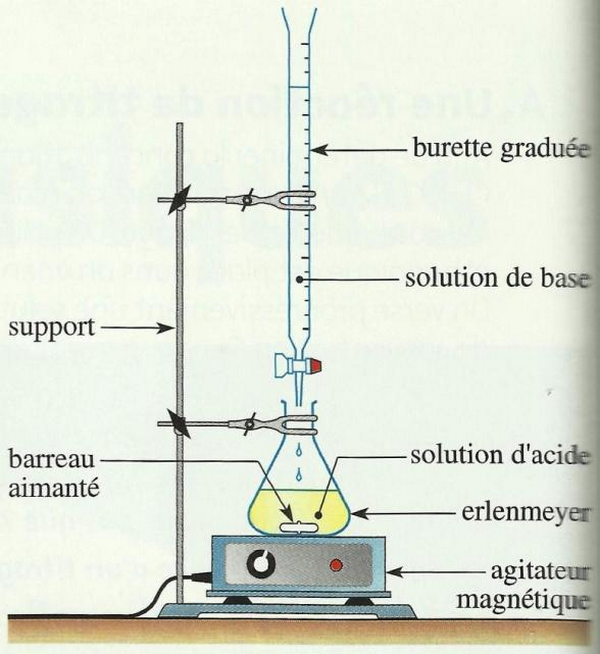
II- Dosage d'une solution d'acide éthanoïque
2-1/ Expérience
Placer, dans un bêcher, un volume de solution d’acide éthanoïque de concentration inconnue.
Y ajouter un volume de solution de soude de concentration .
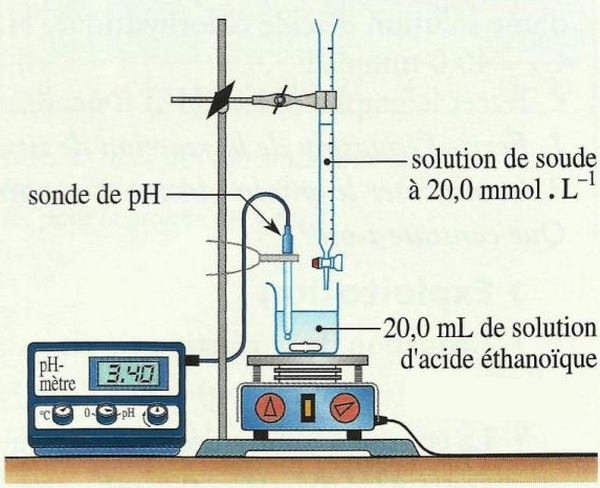
On mesure le pH du mélange après chaque addition et on indique les valeurs obtenues dans le tableau suivant :

II- Dosage d'une solution d'acide éthanoïque
2-1/ Expérience
On trace la courbe représentant la variation du pH en fonction du volume VB de soude versé :
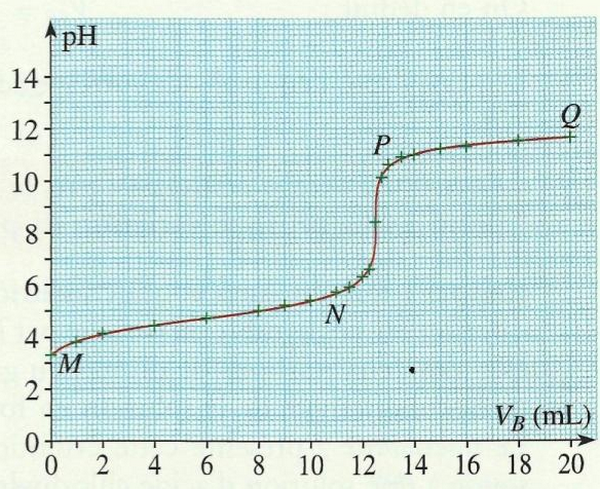
II- Dosage d'une solution d'acide éthanoïque
2-2/ Équation de la réaction du dosage
Les ions Na+ sont inactifs, ils ne participent pas à la réaction du dosage.
L'équation de la réaction du dosage est :
C'est une réaction totale.
II- Dosage d'une solution d'acide éthanoïque
2-3/ Détermination du point d'équivalence
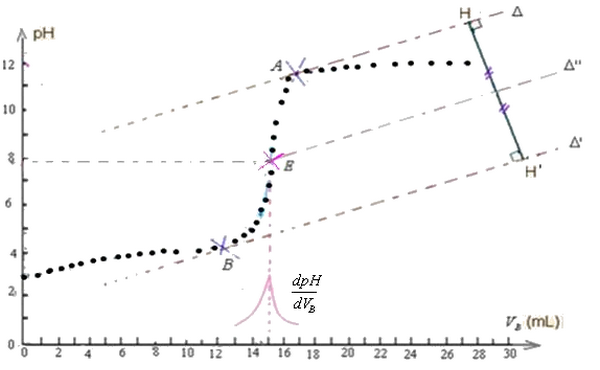
Méthode des tangentes :
On trace la droite tangente à la courbe au point A et on trace la droite parallèle à au point
B, puis on représente le segment perpendiculaire à et à .
Ensuite on trace la droite médiatrice du segment . Cette dernière se coupe avec la courbe au point E.
Coordonnées du point d'équivalence E :
Méthode d’utilisation de l'indicateur coloré :
Expérimentalement on détermine le volume d'équivalence en utilisant un indicateur coloré, lorsque sa couleur change brusquement à la teinte sensible on est à l'équivalence, on obtient donc la valeur du volume de soude versé à l'équivalence.
Dans ce dosage le rouge de crésol est convenable car sa zone de virage contient .
Méthode de la courbe dérivée :
Cette méthode permet de déterminer le volume d'équivalence, elle consiste à tracer, à l'aide
d'un logiciel la courbe dérivée :
Le volume d'équivalence correspond à l'abscisse du maximum de cette courbe :
II- Dosage d'une solution d'acide éthanoïque
2-4/ Relation d'équivalence
Avant l'équivalence, est le réactif limitant
Après l'équivalence, est le réactif limitant.
À l'équivalence le mélange est stœchiométrique :
La relation d'équivalence est donc :
D'où :
II- Dosage d'une solution d'acide éthanoïque
2-5/ Détermination du taux d'avancement final de la réaction
Pour montrer que la réaction du dosage est totale, il suffit de montrer que .
Traçons le tableau d'avancement de la réaction au moment de versement du volume de soude .
D'après la courbe du dosage, le pH correspondant à ce volume est .
Donc la réaction est totale.
III- Dosage d'une solution d'ammoniaque
3-1/ Expérience
On verse dans un bécher un volume d'une solution d'ammoniaque de concentration inconnue, puis on lui ajoute progressivement à l'aide d'une burette graduée une solution d'acide chlorhydrique de concentration .
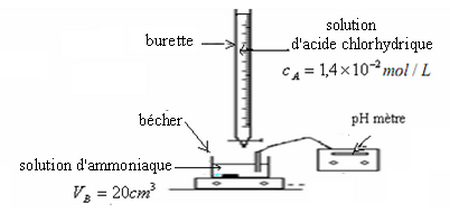
III- Dosage d'une solution d'ammoniaque
3-2/ Équation de la réaction du dosage
Les ions sont inactifs, ils ne participent pas à la réaction du dosage.
l'équation de la réaction du dosage :
C'est une réaction totale.
III- Dosage d'une solution d'ammoniaque
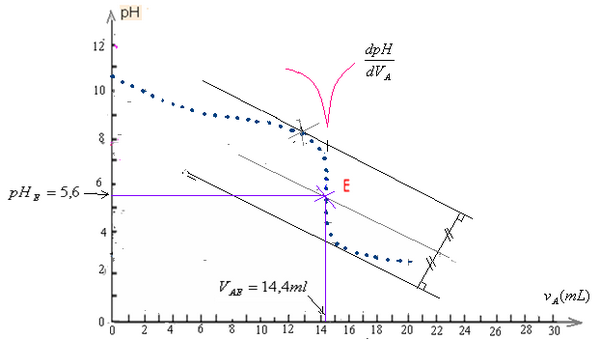
3-3/ Détermination du point d'équivalence
Méthode des tangentes :
Coordonnées du point d'équivalence E :
Méthode de la courbe dérivée :
Elle conduit dans ce cas à :
La méthode de l'indicateur coloré :
D'après le tableau des indicateurs colorés on constate que c'est le rouge de méthyle qui est convenable pour ce dosage, car sa zone de virage contient le .
III- Dosage d'une solution d'ammoniaque
3-4/ Relation d'équivalence
Avant l'équivalence, est le réactif limitant, et après l'équivalence est le réactif limitant.
À l'équivalence le mélange est stœchiométrique :
La relation d’équivalence est donc :
D'où:
IV- Exercices
4-1/ Exercice 1
L’acide propanoïque est utilisé comme conservateur des aliments, son code est E280 , on le trouve dans les fromages, les boissons et les conserves ; il entre également dans la préparation de certains parfums, produits cosmétiques et pharmaceutiques.
On se propose d’étudier en premier lieu, la réaction de l’acide propanoïque avec l’hydroxyde de sodium.
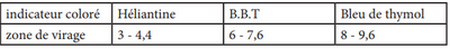
On dose le volume d’une solution aqueuse de l’acide propanoïque de concentration molaire par une solution aqueuse d’hydroxyde de sodium de concentration molaire , en suivant les variations du pH du mélange réactionnel en fonction du volume versé de la solution :
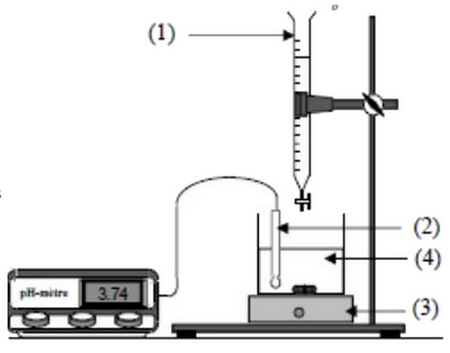
La courbe suivante représente les variations du pH en fonction du volume au cours du dosage :
- Nommer le montage expérimentale de dosage.
- Déterminer les coordonnées et du point d’équivalence.
- En calculant la constante d’équilibre K associée à la réaction du dosage, montrer que cette réaction est totale.
- Calculer la concentration .
- Choisir, en justifiant la réponse, l’indicateur coloré adéquat pour repérer l’équivalence.
- Préciser, en justifiant la réponse, l’espèce chimique prédominante ou après l’ajout du volume
Données :
- Toutes les mesures sont effectuées à
- Le produit ionique de l’eau :
- On représente l’acide propanoïque par et sa base conjuguée par .
- La constante d’acidité du couple est
- Zone de virage de quelques indicateurs colorés :
IV- Exercices
4-2/ Exercice 2
Dosage d'une solution d'acide acétylsalicylique :
On dissout un comprimé d'aspirine dans l'eau distillée. On obtient ainsi une solution aqueuse d'acide acétylsalicylique de concentration , de volume et contenant une quantité de masse de cette acide
On prélève un volume de la solution et on le dose par une solution aqueuse d'hydroxyde de sodium de concentration , en utilisant un indicateur coloré convenable.
- Écrire l'équation de la réaction de dosage.
Pour obtenir l'équivalence, on doit verser le volume de la solution .
- Déterminer la concentration de la solution .
- Montrer que (On donne ).
- Choisir parmi les indicateurs colorés dans le tableau suivant, l'indicateur convenable à ce dosage. Justifier.

IV- Exercices
4-3/ Exercice 3
L’étiquette d’un flacon d’une solution commerciale d’acide méthanoïque porte les informations
suivantes :
- Masse molaire :
- Densité :
- Pourcentage massique :
- Masse volumique de l’eau :
On prépare une solution aqueuse d’acide méthanoïque de concentration molaire et de volume en ajoutant le volume de la solution commerciale , de concentration molaire , à l’eau distillée.
On dose le volume de la solution par une solution aqueuse d’hydroxyde de Sodium de concentration molaire , en suivant les variations du pH du mélange réactionnel en fonction du volume versé de la solution .
À partir des mesures obtenues, on a tracé la courbe représentant et la courbe représentant
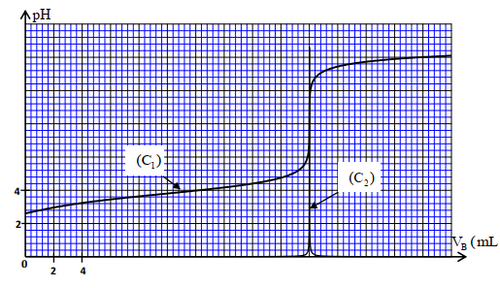
- Écrire l’équation chimique modélisant la transformation ayant lieu lors du dosage.
- Déterminer le volume versé à l’équivalence et calculer la concentration de la solution .
- Vérifier que la valeur de est celle indiquée sur l’étiquette.
- En se basant sur le tableau d’avancement, déterminer l’espèce prédominante parmi les deux espèces et dans le mélange réactionnel après l’ajout du volume de la solution .
- Déduire la valeur du
IV- Exercices
4-4/ Exercice 4
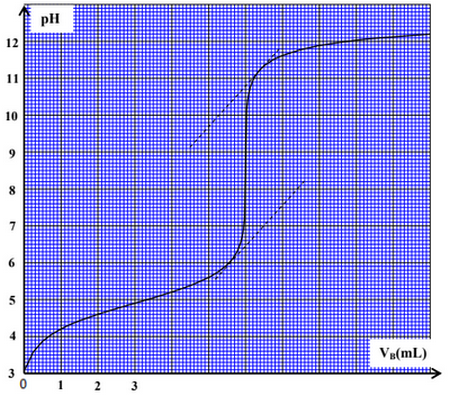
On effectue le dosage ph métrique du volume d’une solution aqueuse d’ammoniaque de concentration , à l’aide d’une solution aqueuse d’acide chlorhydrique de concentration .
- Écrire l’équation chimique modélisant ce dosage
La courbe suivante représente les variations du pH du mélange en fonction du volume de la solution d’acide chlorhydrique ajouté.
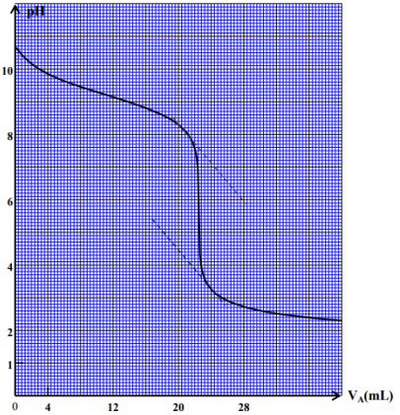
- Déterminer les coordonnées et du point d’équivalence.
- Calculer .
- Déterminer en justifiant votre réponse l’indicateur coloré convenable pour effectuer ce dosage en l’absence du pH mètre.

- Déterminer le volume de la solution d’acide chlorhydrique qu’il faut ajouter pour que la relation soit vérifiée dans le mélange réactionnel. on donne :


