
Physique et Chimie : 1ère Année Bac
Séance 24 (Modification du squelette carboné)
Professeur : Mr EL GOUFIFA Jihad
Sommaire
I- Production des carburants
II- Technique de modifications de la chaîne carbonée
2-1/ Raccourcissement de squelettes du carbone
2-2/ Reformage catalytique
2-3/ Allongement de la chaîne de carbone
III- Exercices
3-1/ Exercice 1
3-2/ Exercice 2
3-3/ Exercice 3
3-4/ Exercice 4
I- Production des carburants
La pétrochimie consiste à transformer le pétrole brut, généralement inutilisable directement, en produits adaptés à la demande des consommateurs.
C’est le cas des gaz utilisés comme combustibles (propane et butane), des gazoles, des carburants des moteurs diesels et du kérosène …
II- Technique de modifications de la chaîne carbonée
2-1/ Raccourcissement de squelettes du carbone
Craquage catalytique
Le craquage est une opération au cours de laquelle on obtient des hydrocarbures légers à partir des hydrocarbures lourds. Le craquage est catalytique s’il se fait en présence d’un catalyseur.
Exemple :
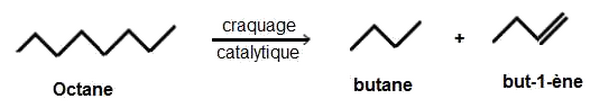
II- Technique de modifications de la chaîne carbonée
2-1/ Raccourcissement de squelettes du carbone
Vapocraquage
Il se fait en présence d’eau, en l’absence du catalyseur et à une température voisin de 800°C.
Il produit essentiellement des alcènes.
Exemple :
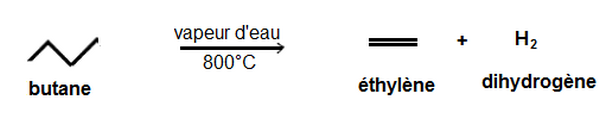
II- Technique de modifications de la chaîne carbonée
2-2/ Reformage catalytique
Définition
Il permet de changer la structure de la chaîne carbonée sans changer le nombre des atomes selon le choix du catalyseur, on oriente la réaction vers une isomérisation ou vers une cyclisation.
II- Technique de modifications de la chaîne carbonée
2-2/ Reformage catalytique
Ramification
Un alcane à chaîne linéaire peut se transformer en un isomère à chaîne ramifiée.
Exemple :
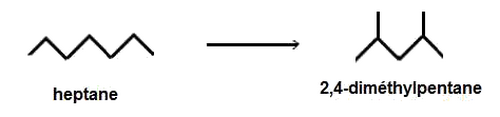
II- Technique de modifications de la chaîne carbonée
2-2/ Reformage catalytique
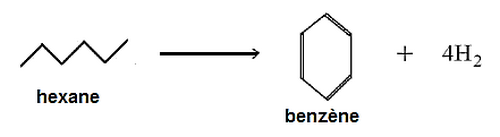
Cyclisation
A partir d’un alcane linéaire, on obtient un alcane cyclique avec formation du dihydrogène.
Exemple :
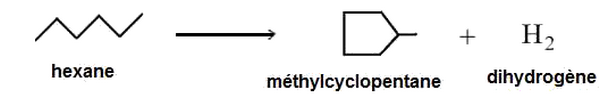
II- Technique de modifications de la chaîne carbonée
2-2/ Reformage catalytique
Déshydrogénation
Elle consiste à transformer une liaison covalente simple C-C en une liaison double C=C, c’est-à-dire former des alcènes.
Exemple :
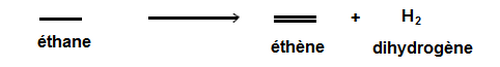
Remarque :
Une hydrogénation peut être accompagnée d’une cyclisation.
II- Technique de modifications de la chaîne carbonée
2-3/ Allongement de la chaîne carbonée
Par alkylation
Une alkylation est une substitution d’un atome d’hydrogène d’une chaîne carbonée par un groupe alkyle.
Elle peut s’effectuer en combinant un alcane léger et un alcène léger pour obtenir un alcane plus lourd. C’est l’opération inverse du craquage.
Exemple :
II- Technique de modifications de la chaîne carbonée
2-3/ Allongement de la chaîne carbonée
Par polymérisation
Une polymérisation est une addition répétée d’un grand nombre de molécules insaturées appelées monomères ; il résulte de la formation d’une macromolécule nommée polymère.
D’une manière générale on peut écrire l’équation de la réaction de polyaddition sous forme :
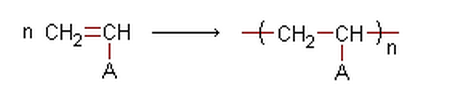
est appelé indice de polymérisation et le groupe
est appelé motif du polymère.
II- Technique de modifications de la chaîne carbonée
2-3/ Allongement de la chaîne carbonée
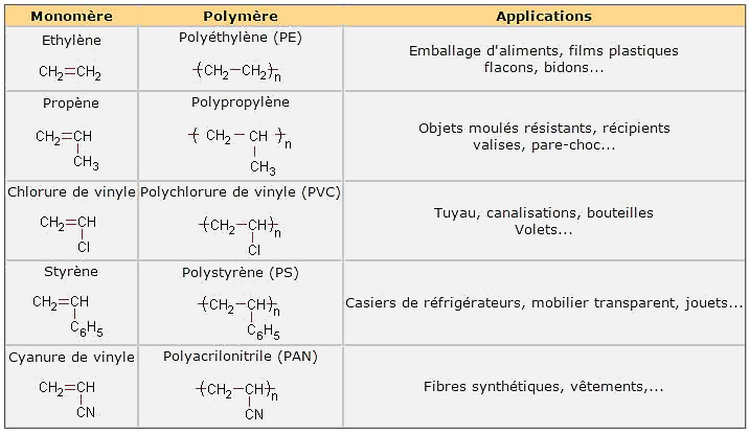
Exemples de polymère et leurs principales applications
III- Exercices
3-1/ Exercice 1
La déshydrogénation du butane conduit à l’apparition d’un hydrocarbure non saturé sous forme de deux isomères de formation.
- Donner les formules semi-développées des deux isomères.
L’un des deux se caractérise lui aussi par deux autres isomères.
- Écrire la formule semi-développée de chaque isomère. Donner son nom.
III- Exercices
3-2/ Exercice 2
Le craquage catalytique d’un alcane donne un mélange équimolaire constitué de méthylpropène, d’éthène et de dihydrogène.
- Écrire la formule semi-développée de chacun de ces produits. Déduire la formule brute de l’alcane .
- Donner les écritures topologiques et les noms des isomères de .
- Sachant que la molécule de A possède une seule ramification et que le craquage d’une seule liaison suffit pour donner les produits précédents, déduire l’isomère utilisé.
III- Exercices
3-3/ Exercice 3
Par craquage catalytique du butane, on obtient l’un des cas suivants :
- Formation du méthane et du propène.
- Formation d’éthène et d’éthane
- Formation du butène et du dihydrogène.
- Écrire les équations des trois réactions possibles.
- Sachant que des molécules du butane se transforment en éthène et éthane, calculer la masse d’éthène formé par traitement de du butane.
- Calculer le volume d’éthène formé à et sous pression atmosphérique.
Données
- Pression atmosphérique :
- le volume molaire :
- Masses molaires :
III- Exercices
3-4/ Exercice 4
La polymérisation d’un alcène conduit à la formation d’un polymère de masse molaire moléculaire et d’indice de polymérisation .
- Calculer la masse molaire de l’akène , déterminer sa formule brute.
- Donner la formule semi-développée et le nom du composé .
L’alcène réagit avec le chlorure d’hydrogène et donne un composé qui est 1-chloropropane.
- Écrire l’équation de cette réaction en utilisant les formules semi-développées.
- Écrire la formule semi-développée de l’isomère de . donner son nom.
On donne :


