
Physique et Chimie : Tronc Commun
Séance 19 (La concentration molaire)
Professeur : Mr EL GOUFIFA Jihad
Sommaire
I- Définition d’une solution aqueuse
II- Notion de concentration
2-1/ Notion de concentration massique
2-2/ Notion de concentration molaire
2-3/ La relation entre concentration molaire et massique
III- Dilution d'une solution aqueuse
3-1/ Principe de la dilution
3-2/ Conservation de la quantité de matière
3-3/ Mode opératoire
IV- Exercices
4-1/ Exercice 1
4-2/ Exercice 2
4-3/ Exercice 3
4-4/ Exercice 4
I- Définition d’une solution aqueuse
Une solution est obtenue par dissolution d'une espèce chimique dans un liquide appelé solvant : l'espèce chimique dissoute est appelée soluté.
Dans une solution, le solvant est l'espèce chimique majoritaire et le soluté est l’espèce minoritaire.
Il y une limite à la solubilité d'une espèce chimique dans un solvant : si l'on dépasse cette limite on obtient une solution saturée.
Le soluté peut être : un solide, un liquide ou un gaz.
Le solvant peut être : l’eau ou un liquide organique (alcool ou cyclohexane….).
Lorsque le solvant est l’eau, la solution est dite aqueuse.
Exemple
En dissolvant des cristaux de chlorure de sodium dans l’eau, on obtient une solution aqueuse de chlorure de sodium.
II- Notion de concentration
2-1/ Notion de concentration massique
On appelle, concentration massique , le rapport entre la masse de soluté dissous et la volume totale de la solution :
La concentration massique est exprimée en .
II- Notion de concentration
2-2/ Notion de concentration molaire
La concentration molaire d’une espèce chimique en solution est égale à la quantité de matière de cette espèce présente dans un litre de solution, c'est le rapport entre la quantité matière de soluté dissous et la volume totale de la solution. :
La concentration molaire est exprimée en .
II- Notion de concentration
2-3/ La relation entre concentration molaire et massique
On a avec
Donc
III- Dilution d'une solution aqueuse
3-1/ Principe de la dilution
Diluer une solution, c’est ajouter du solvant (l’eau distillé), pour préparer une nouvelle solution moins concentrée que la solution initiale .
La solution de départ est appelée solution initiale ou solution mère.
La solution diluée est appelée solution finale ou solution fille.
La concentration molaire de la solution finale (solution fille) est toujours inférieure à la concentration molaire de la solution initiale (solution mère) :
III- Dilution d'une solution aqueuse
3-2/ Conservation de la quantité de matière
Lors d’une dilution, la concentration molaire du soluté diminue, mais sa quantité de matière ne change pas.
Il y a conservation de la quantité de matière de soluté de la solution mère et de la quantité de matière de la solution fille.
On écrit : . Cette relation s’appelle relation de dilution
On définit le facteur de dilution par la relation :
III- Dilution d'une solution aqueuse
3-3/ Mode opératoire
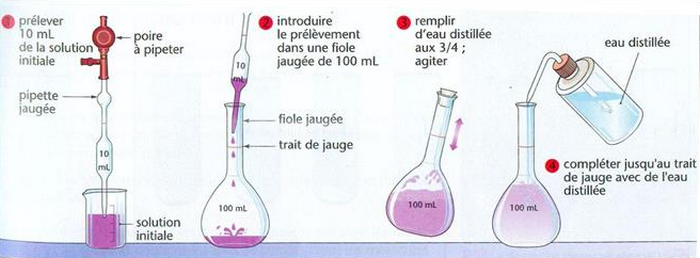
IV- Exercices
4-1/ Exercice 1
On prépare une solution de chlorure de sodium en dissolvant de chlorure de sodium dans un litre d'eau.
- Identifier le corps soluté et le corps solvant.
- Calculer la quantité de matière de soluté dissoute dans l'eau.
- Calculer la concentration de la solution de chlorure de sodium.
On prépare une solution de sulfate de cuivre II en dissolvant de sulfate de cuivre II anhydre dans un demi-litre d'eau.
- Identifier le corps soluté et le corps solvant.
- Calculer C la concentration molaire de la solution de sulfate de cuivre II.
- Calculer la masse de soluté dissoute dans l'eau.
- Calculer la concentration massique Cm de soluté.
Données
Masses molaires en g/mol :
IV- Exercices
4-2/ Exercice 2
On dissout de chlorure de sodium dans d’eau distillée, on obtient une solution .
- Dire quelles substances représentent le soluté et le solvant.
- Calculer la concentration massique en chlorure de sodium de la solution ainsi obtenue.
- Déduire la concentration molaire de la même solution.
On ajoute à la solution un volume d’eau distillée, on obtient une solution de concentration molaire .
- Calculer le volume d’eau ajoutée .
- Calculer le coefficient de dilution .
IV- Exercices
4-3/ Exercice 3
On fait dissoudre une masse de chlorure de fer II dans l’eau pour préparer une solution de volume .
- Qu’appelle-t-on la solution ?
- Calculer la concentration massique de la solution .
- Calculer la quantité de matière du soluté dissout dans .
- Calculer la concentration molaire de la solution .
On dispose maintenant d’une solution aqueuse de chlorure de fer II et de concentration et de volume .
On mélange dans un même bêcher la solution et la solution pour obtenir une solution .
- Calculer la quantité de matière du soluté dissout dans .
- Calculer la quantité de matière totale de soluté dissout dans la solution .
- Déduire la concentration molaire de cette solution .
- Déduire la concentration massique de la même solution .
Données
Masses molaires :
IV- Exercices
4-4/ Exercice 4
Un flacon de déboucheur pour évier porte les indications suivantes: " Produit corrosif; contient de l’hydroxyde de sodium (soude caustique); Solution à ; La densité du produit est ".
Le pourcentage indiqué représente le pourcentage massique d’hydroxyde de sodium contenu dans le produit.
- Calculer la masse d’hydroxyde de sodium contenu dans de produit.
- En déduire la concentration en soluté hydroxyde de sodium de la solution commerciale.
On désire préparer un volume de solution de déboucheur fois moins concentré que la solution commerciale.
- Quelle est la valeur de la concentration de la solution ?
- Quelle est la quantité de matière d’hydroxyde de sodium contenu dans de solution ?
- Quel volume de solution commerciale a-t-il fallu prélever pour avoir cette quantité de matière d’hydroxyde de sodium ?


