
Physique et Chimie : 2ème Année Collège
Séance 4 (Les combustions)
Professeur : Mr El GOUFIFA Jihad
Sommaire
I- Introduction
II- La combustion
2-1/ Définition
2-2/ Combustion complète et incomplète
III- Combustion du carbone
3-1/ Expérience
3-2/ Observation
3-3/ Conclusion
IV- Combustion du butane
4-1/ Combustion complète du butane
4-2/ Combustion incomplète du butane
V- Dangers des combustions
VI- Exercices
6-1/ Exercice 1
6-2/ Exercice 2
6-3/ Exercice 3
6-4/ Exercice 4
I- Introduction
De nombreux matériaux brûlent dans l’air : c’est ce qu’on appelle une combustion.
- Que signifie (brûler)?
- Quels sont les produits formés ?
- Pourquoi certaines de ces combustions sont dangereuses?
II- La combustion
2-1/ Définition
Une combustion est une transformation chimique au cours de laquelle une substance brûle.
Cette transformation chimique nécessite toujours deux réactifs : un combustible et un comburant.
- Le combustible est la substance qui peut brûler.
- Le comburant est la substance qui est capable de faire brûler le combustible.
Exemples de combustible: le papier, le bois, le pétrole, le charbon, l'huile, l'alcool, ....
Le comburant est généralement le dioxygène.
Cette réaction s'accompagne toujours d'un dégagement de chaleur (réaction exothermique).
2-2/ Combustion complète et incomplète
La combustion de substances peut être complète en présence d'une quantité suffisante de dioxygène.
S'il n'y a pas assez de dioxygène la combustion est dite incomplète car il se forme des produits qui peuvent eux même servir de combustible, ces produits sont en général le carbone et un gaz toxique : le monoxyde de carbone.
III- Combustion du carbone
Le charbon de bois est constitue essentiellement de carbone (environ 90%)
Le carbone est un corps constitué d’atomes de carbone C
3-1/ Expérience
- Placer un morceau de fusain à incandescence dans un flacon fermé rempli d’air.
- Placer le morceau de fusain enflammé dans un autre flacon fermé de dioxygène pur.
- Verser, dans le flacon, une quantité de l’eau de chaux à la fin de la combustion, et agiter.

3-2/ Observation
Dans le flacon contenant de l'air la combustion s'effectue sans flamme, le morceau de fusain reste incandescent quelques instants puis s'éteint.
Dans le flacon contenant du dioxygène pur la combustion est beaucoup plus vive que dans l'air. Elle dégage davantage de chaleur et de lumière. La réaction dure plus longtemps.
L'eau de chaux se trouble.
3-3/ Conclusion
La combustion du carbone dans le dioxygène a produit du dioxyde de carbone.
On peut écrire le bilan de cette transformation :

IV- Combustion du butane
4-1/ Combustion complète du butane
Le butane est le gaz que l'on trouve dans les bouteilles à gaz ou dans les briquets.
Expérience
Le bec bunsen est relié à une bouteille contenant du butane. Réalisons la combustion du butane et plaçons un tube a essai au-dessus de la flamme afin de récupérer les gaz de combustion. Introduisons de l’eau de chaux.
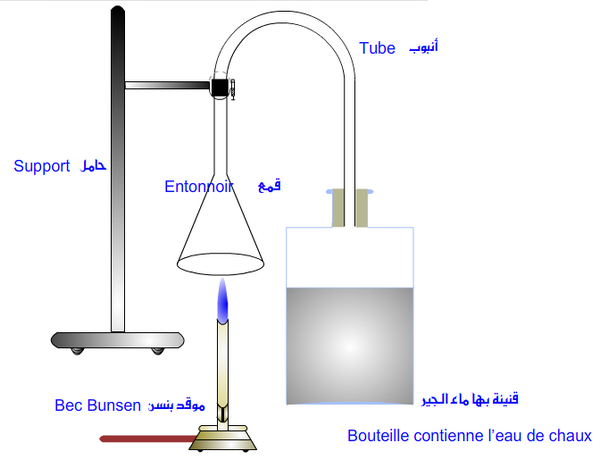
Observation
- La flamme est bleue.
- Il se forme de la buée (eau).
- Il se forme du dioxyde de carbone, car lorsque l'on met de l'eau de chaux dans le verre à pied, elle se trouble.
Interprétation
La présence de la buée montre que de l'eau s'est formée.
Le test à l'eau de chaud montre la formation de dioxyde de carbone.
Le butane est un combustible, il réagit avec le dioxygène contenu dans l'air qui joue le rôle de comburant.
Conclusion
Lors de la combustion complète du butane : le combustible (butane) et le comburant (dioxygène) sont consommés.
Il se forme des produits nouveaux : la vapeur d'eau (buée) et le dioxyde de carbone (eau de chaux troublée).
Le bilan de cette combustion est :
IV- Combustion du butane
4-2/ Combustion incomplète du butane
Expérience
Plaçons une soucoupe au-dessus de la flamme.
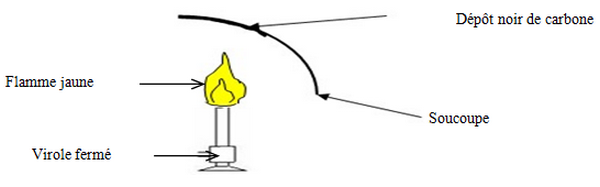
Observation
S'il n'y a pas suffisamment de dioxygène lors de la combustion du butane, la flamme devient jaune et éclairante.
Il se forme de la buée (eau) et un dépôt noir.
Il se forme du dioxyde de carbone, car lorsque l'on met de l'eau de chaux dans le verre à pied, elle se trouble.
Il se forme du carbone et aussi le monoxyde de carbone, gaz incolore et inodore, (gaz toxique, voir mortel).
Conclusion
Lorsque le dioxygène est en quantité insuffisante, la combustion est dite incomplète. Et Il se forme des produits nouveaux : la vapeur d'eau (buée), le dioxyde de carbone (eau de chaux troublée), aussi des particules de carbone et le monoxyde de carbone (gaz mortel).
Le bilan de cette combustion est :

V- Dangers des combustions
Les combustions présentent différents risques :
- Risque d'incendie : si la combustion se propage à d'autres objets ; il faut donc éloigner des flammes toute matière combustible
- Risque d'asphyxie : si le dioxygène de l'air est consommé par la combustion ; il faut donc éviter de boucher les ventilations.
- Risque d'intoxication par le monoxyde de carbone : si la combustion est incomplète ; il faut donc bien faire régler.
VI- Exercices
6-1/ Exercice 1
- Entourer la bonne réponse. Pour chaque question, une seule réponse est valable.
a) Au cours d'une combustion, le dioxygène est:
- Le combustible.
- Le comburant.
- Le carburant.
b) Un des réactifs de la combustion du butane est:
- L'eau de chaux.
- L'eau.
- Le dioxygène.
c) On prouve la présence du dioxyde de carbone avec:
- L’eau.
- L'eau de chaux.
- Le sulfate de cuivre anhydre.
d) Les corps consommés au cours d'une transformation chimique sont:
- Les produits.
- Les réactifs.
- Les réactifs et les produits.
e) Au cours d'une combustion incomplète, il peut se libérer un gaz toxique:
- Le monoxyde de carbone.
- Le butane.
- Le carbone.
VI- Exercices
6-2/ Exercice 2
On réalise la combustion du butane contenu dans un briquet.
Un tube à essai est maintenu au-dessus de la flamme qui est réglée de façon à être bleue.
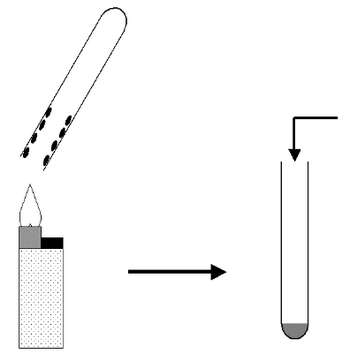
- Qu’observe-t-on sur les parois intérieures du tube ?
On verse ensuite dans le tube un réactif qui se trouble après quelques instants.
- Quel est le nom de ce réactif ?
- Quelle est l'espèce chimique mise en évidence ?
- Écrire le bilan chimique de cette transformation chimique en précisant les réactifs et les produits.
VI- Exercices
6-3/ Exercice 3
On étudie la combustion du méthane dans le dioxygène et on suppose que la combustion est complète.
- Quel(s) est (sont) le(s) réactif(s) ?
- Quel(s) est (sont) le(s) produit (s) ?
- Écrire l’équation bilan de la réaction chimique
- Quel est le test qui met en évidence le dioxyde de carbone ?
- Quel est le test qui met en évidence l’eau ?
- Schématiser (avec une légende) le test qui a permis de trouver le produit de la réaction.
VI- Exercices
6-4/ Exercice 4
Sanae a utilisé une bouteille de gaz butane dans la cuisine et deux becs bunsen, elle a observé que :
Lorsqu’elle mette une casserole sur le bec bunsen 1 : dépôt noir et une flamme jaune éclairante.
Lorsqu’elle mette une casserole sur le bec bunsen 2 : reste propre et une flamme bleue plus chaude.
- Donner le type de combustion pour le gaz butane dans les deux becs bunsen, puis le nom de la substance formant un dépôt noir.
- Écrire le bilan chimique (Bec bunsen 2).
- Proposer une solution pour éviter la formation d'un dépôt noir.


