
Physique et Chimie : 1ère Année Collège
Séance 12 (Le corps pur et ses caractéristiques)
Professeur : Mr El GOUFIFA Jihad
Sommaire
I- Caractéristiques d'un mélange (eau salée) à l'ébulition
1-1/ Expérience
1-2/ Tableau des résultats
1-3/ Courbe
1-4/ Conclusion
II- Caractéristiques d'un mélange (eau salée) à la fusion
2-1/ Expérience
2-2/ Tableau des résultats
2-3/ Courbe
2-4/ Observation
2-5/ Conclusion
III- Caractéristiques d'un corps pur (eau pure) à l'ébulition
3-1/ Expérience
3-2/ Tableau des résultats
3-3/ Courbe
3-4/ Conclusion
IV- Caractéristiques d'un corps pur (eau pure) à la fusion
4-1/ Expérience
4-2/ Tableau des résultats
4-3/ Courbe
4-4/ Observation
4-5/ Conclusion
V- Caractéristiques d’un corps pur
5-1/ Exemples
VI- Exercices
6-1/ Exercice 1
6-2/ Exercice 2
6-3/ Exercice 3
6-4/ Exercice 4
I- Caractéristiques d'un mélange (eau salée) à l'ébulition
1-1/ Expérience
On chauffe une quantité d’eau salée, on relève la température du mélange à des dates différentes tout en suivant l’état physique de l’eau.

1-2/ Tableau des résultats
| Temps (min) | 0 | 2 | 4 | 5 | 6 | 9 | 12 | 15 | 18 | 21 |
| Température (°C) | 41 | 54 | 88 | 100 | 103 | 103,5 | 104 | 104,5 | 105 | 105,5 |
| État physique | Liquide | Liquide et gaz | ||||||||
I- Caractéristiques d'un mélange (eau salée) à l'ébulition
1-3/ Courbe
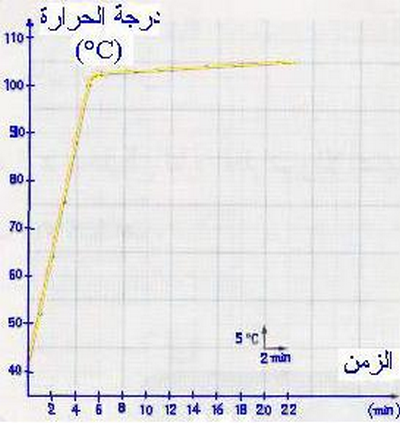
1-4/ Conclusion
La température du mélange augmente rapidement durant le chauffage jusqu’à la température 103°C, tandis qu’au moment du changement d’état physique (la vaporisation ), la température augmente toujours mais de façon lente.
II- Caractéristiques d'un mélange (eau salée) à la fusion
2-1/ Expérience
On chauffe une glace salée, et on enregistre la température au-bout de chaque minute.
2-2/ Tableau des résultats
| Temps (min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 10 | 11 |
| Température (°C) | -6 | -4 | -2 | -1 | 0 | 1 | 2 | 3 | 4 | 5 | 8 |
| État physique | Solide | Solide et liquide | Liquide | ||||||||
II- Caractéristiques d'un mélange (eau salée) à la fusion
2-3/ Courbe
2-4/ Observation
La température du mélange augmente rapidement durant le chauffage jusqu’à la température - 1°C, tandis qu’au moment du changement d’état physique (La fusion), la température augmente toujours mais de façon lente.
2-5/ Conclusion
La température d’un mélange varie lentement durant le changement d’état physique.
III- Caractéristiques d'un corps pur (eau pure) à l'ébulition
3-1/ Expérience
On chauffe une quantité d’eau pure, on relève la température du mélange à des dates différentes tout en suivant l’état physique de l’eau.

3-2/ Tableau des résultats
| Temps (min) | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| Température (°C) | 20 | 45 | 60 | 75 | 88 | 96 | 100 | 100 | 100 | 100 | 100 |
| État physique | Liquide | Liquide et gaz | |||||||||
III- Caractéristiques d'un corps pur (eau pure) à l'ébulition
3-3/ Courbe
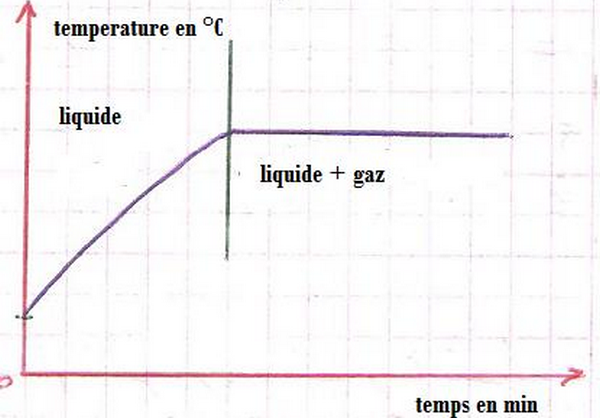
3-4/ Conclusion
La température de l’eau pure augmente rapidement durant le chauffage sans avoir un changement d’état physique,
Lorsque la température atteint 100°C, cette valeur reste constante durant le changement d’état physique (la vaporisation).
IV- Caractéristiques d'un corps pur (eau pure) à la fusion
4-1/ Expérience
On chauffe une glace d’eau distillée, et on enregistre la température au-bout de chaque minute.
4-2/ Tableau des résultats
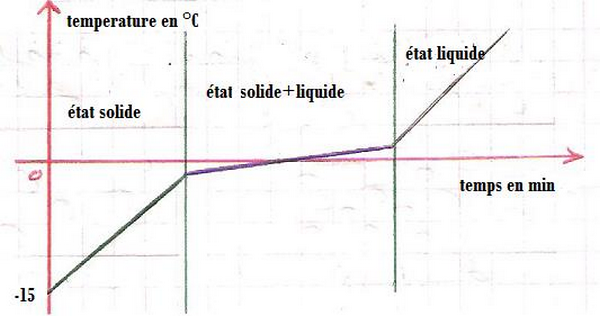
| Temps (min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 10 | 11 |
| Température (°C) | -6 | -4 | -2 | -1 | 0 | 0 | 0 | 0 | 4 | 5 | 8 |
| État physique | Solide | Solide et liquide | Liquide | ||||||||
IV- Caractéristiques d'un corps pur (eau pure) à la fusion
4-3/ Courbe

4-4/ Observation
On constate que la température de l’eau pure augmente sans changement d’état physique.
Lorsque la température atteint 0°C, cette valeur reste constante durant le changement d’état physique (la fusion).
4-5/ Conclusion
Lorsque l'eau pure solide subit une fusion, sa température est de 0 °C, et cette température reste constante jusqu'à ce que toute la glace se soit transformée en eau liquide.
On dit que la température de fusion de l'eau est de 0 °C.
Lorsque la glace et l'eau liquide coexistent, la température est de 0 °C : la fusion et la solidification de l'eau se font à température constante.
V- Caractéristiques d’un corps pur
Les températures de fusion (ou de solidification) et d’ébullition (ou de condensation) sont parmi les caractéristiques d’un corps pur.
5-1/ Exemples
| Corps pur | Température de fusion et solidification (°C) | Température d’ébullition et liquéfaction (°C) |
| Eau | 0 | 100 |
| Alcool | - 110 | 79 |
| Mercure | - 39 | 357 |
| Fer | 1538 | 2861 |
| Cuivre | 1083 | 2927 |
| Aluminium | 660 | 2467 |
| Dioxygène | - 218 | - 183 |
| Diazote | - 209 | - 195 |
VI- Exercices
6-1/ Exercice 1
Placer les mots suivants dans la bonne place : solide, substance, température, liquide, gaz
Un corps est appelé corps pur lorsqu’il ne contient qu’une seule ______________ .
Un corps pur peut être un ______________ , un ______________ ou un ______________ .
Pour un corps pur la ______________ ne change pas pendant le changement d’état.
VI- Exercices
6-2/ Exercice 2
On fait chauffer deux liquides A et B séparés, lors de l'ébullition on repère la température de chaque liquide au bout d’une minute.
On obtient les résultats suivants:
| Durée (min) | 0 | 1 | 2 | 3 | 4 | 5 |
| Température du liquide A (°C) | 76 | 77 | 78 | 78 | 78 | 78 |
| Température du liquide B (°C) | 74 | 76 | 78 | 80 | 81 | 82 |
1- Quel est le liquide qui représente un corps pur ? justifiez votre réponse.
2- Quel est le liquide qui représente un mélange ? justifiez votre réponse.
VI- Exercices
6-3/ Exercice 3
Répondre par Vrai ou par Faux :
- Tous les corps purs sont homogènes : _________
- Une substance qui n’est pas un mélange est un corps pur : _________
- Toutes les substances homogènes sont des corps purs : _________
- Une eau claire est un corps pur : _________
VI- Exercices
6-4/ Exercice 4
- Donner la définition d'un corps pur.
- Donner ses caractéristiques.


