
Physique et Chimie : 1ère Année Bac
Séance 26 (La réactivité des alcools)
Professeur : Mr EL GOUFIFA Jihad
Sommaire
I- Oxydation complète et oxydation ménagée
1-1/ Oxydation complète à l’aide du dioxygène (ou combustion)
1-2/ Oxydation ménagée au milieu aqueux
II- Oxydation des alcools
2-1/ Oxydation des alcools primaires
2-2/ Oxydation des alcools secondaires
2-3/ Oxydation des alcools tertiaires
2-4/ Déshydratation des alcools
2-5/ Réaction de substitution
III- Passage d’un groupe caractéristique à un autre
IV- Rendement d’une synthèse
V- Tests de caractérisation
VI- Méthode pour déterminer la classe d’un alcool
VII- Exercices
7-1/ Exercice 1
7-2/ Exercice 2
7-3/ Exercice 3
7-4/ Exercice 4
I- Oxydation complète et oxydation ménagée
1-1/ Oxydation complète à l’aide du dioxygène (ou combustion)
Au cours d’une oxydation complète, la structure carbonée est détruite. Il se forme du dioxyde de carbone et de l’eau .
L’équation générale de la combustion s’écrit :
Exemple
L’équation de la combustion de l’éthanol :
I- Oxydation complète et oxydation ménagée
1-2/ Oxydation ménagée au milieu aqueux
Au cours d’une oxydation ménagée, la structure carbonée est conservé, seul le carbone qui porte la fonction est attaqué et se transforme.
L’oxydation ménagée peut se faire l’ion permanganate en solution aqueuse.
II- Oxydation des alcools
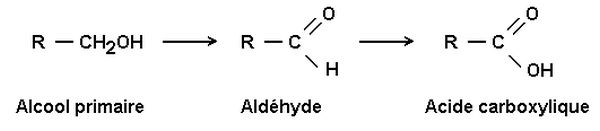
2-1/ Oxydation des alcools primaires
L’oxydation ménagée d’un alcool primaire différent selon la quantité de l’oxydant utilisée.
1er cas : l’oxydant est en défaut
Les alcools primaire sont transformés en aldéhydes par action d’un oxydant en défaut.
Écrire l’équation d’oxydation de l’éthanol par l’ion permanganate :
Les deux couples redox sont : et
L’équation bilan de la réaction :
II- Oxydation des alcools
2-1/ Oxydation des alcools primaires
2ème cas : l’oxydant est en excès
Si l’oxydant est en excès, l’oxydation de l’éthanol conduit à la formation de l’acide
éthanoïque :
L’équation bilan de la réaction :
Remarque
L’alcool primaire est d’abord transformé en aldéhyde, puis l’aldéhyde en acide carboxylique :
II- Oxydation des alcools
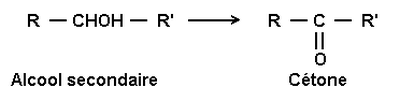
2-2/ Oxydation des alcools secondaires
Les alcools secondaires sont oxydés en cétones par l’ion permanganate.
Exemple
L’équation d’oxydation de propane-2-ol par l’ion permanganate :

L’équation bilan de la réaction :

Conclusion
L’oxydation d’un alcool secondaire conduit à la formation d’une cétone :
II- Oxydation des alcools
2-3/ Oxydation des alcools tertiaires
Les alcools tertiaires ne sont pas oxydés dans les conditions de l’oxydation ménagée :

II- Oxydation des alcools
2-4/ Déshydratation des alcools
La déshydratation d’un alcool est la réaction d’élimination d’une molécule d’eau de la chaîne carbonée de l’alcool :

Les alcools tertiaires se déshydratent plus facilement que les alcools I et II :

D’une façon générale, la déshydratation d’un alcool a pour équation :

II- Oxydation des alcools
2-5/ Réaction de substitution
Au cours d’une réaction de substitution le groupe hydroxyle est remplacé par un atome
d’halogène :
Exemple

III- Passage d’un groupe caractéristique à un autre
Le passage d’un groupe caractéristique à un autre permet de créer de nouvelles molécules organiques.
L’oxydation, la déshydratation des alcools et le passage d’un alcool à un halogène sont des exemples de passage d’un groupe caractéristique à un autre.
Exemple : le méthanol et ses dérivés

La chimie organique est une chimie créatrice de nouvelles molécules.
IV- Rendement d’une synthèse
Lors de la synthèse d’un produit, la quantité de matière du produit obtenu expérimentalement est inférieure à celle attendu théoriquement.
On appelle rendement de la synthèse d’un produit le quotient de la quantité de matière expérimentalement du produit sur sa quantité de matière théorique :
Le rendement est sans unité, sa valeur est comprise entre 0 et 1, et il peut être exprimé en pourcentage (%).
Remarque
Le rendement peut aussi s’exprimer en fonction des masses :
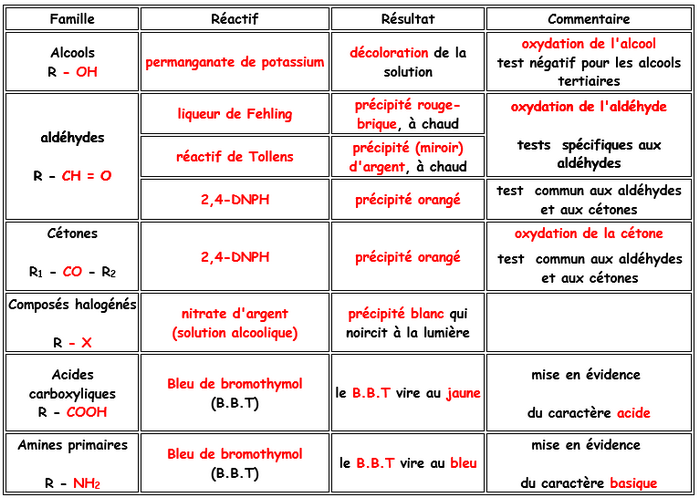
V- Tests de caractérisation
VI- Méthode pour déterminer la classe d’un alcool
Connaissant le résultat de l'oxydation, on peut en déduire la classe de l'alcool.
On prendra comme oxydant l'ion de coloration violette :
- Si après réaction la solution est décolorée alors l'alcool de départ était primaire ou secondaire car les alcools tertiaires ne s'oxydent pas.
- Si le test à la est positif (apparition d'un précipité jaune), le produit présente un groupe carbonyle. Il s'agit donc d'une cétone ou d'un aldéhyde. On doit effectuer un test supplémentaire pour conclure.
- Si le test au réactif de Fehling est positif (apparition d'un précipité rouge brique), on a affaire à un aldéhyde, donc l 'alcool oxydé est primaire. Dans le cas contraire, l'alcool de départ était secondaire
- Si l'oxydation conduit à un composé acide, l'alcool de départ était primaire. L'acidité du produit peut être testée à l'aide de papier pH.

VII- Exercices
7-1/ Exercice 1
En présence d’une solution alcoolique, un composé organique donne un précipité blanc.
- Quelle est la famille du composé organique ?
- Quel est le groupe caractéristique correspondant ?
Deux béchers contiennent, l’un du cyclohexane, l’autre du cyclohexène.
- Proposer un test de caractérisation permettant d’identifier ces deux composés organiques.
VII- Exercices
7-2/ Exercice 2
- Écrire l’équation de réaction de l’oxydation ménagée du butan-l-ol en milieu acide par les ions permanganate introduits en excès.
- Même question pour le butan-2-ol. Est-il nécessaire d’utiliser les ions permanganate en excès dans ce cas ? Justifier votre réponse.
VII- Exercices
7-3/ Exercice 3
La déshydratation d’un alcool conduit à la formation d’un hydrocarbure dont la densité de sa vapeur est .
- Quelle est la nature du composé de formule générale ?
- Calculer la masse molaire du composé B, en déduire sa formule brute.
- Écrire l’équation de déshydratation du composé .
- Déduire la formule générale du composé .
- Écrire les formules semi-développées possibles de .
- Quelle est la formule semi-développée de l’alcool sachant que son oxydation ménagée donne la formation d’un aldéhyde.
VII- Exercices
7-4/ Exercice 4
On réalise la réaction du volume du cyclopentène, de modèle moléculaire ci-dessous, avec une solution aqueuse d’acide sulfurique :
Après les phases de séparation et de distillation, il se forme de cyclopentanol.
On introduit la masse mj dans un ballon, on y ajoute une solution acidifiée de permanganate de potassium en excès.
Après chauffage à reflux, séparation et distillation, on obtient du cyclopentanone.
- Écrire les formules brutes, et les schémas topologiques des composés cités dans l’énoncé de l’exercice.
- Trouver la valeur du rendement de la synthèse du cyclopentanol.
La masse volumique du cyclopentène est .
- Calculer le rendement de la synthèse du cyclopentanone.


