
Physique et Chimie : Tronc Commun
Séance 19 (Modélisation des transformations chimiques - Bilan de la matière)
Professeur : Mr EL GOUFIFA Jihad
Sommaire
I- Modélisation des transformations chimiques d'un système
1-1/ L'état initial et l'état finale d'un système chimique
1-2/ Modélisation des transformations chimiques
1-3/ Relation entre quantité de la matière et coefficients stœchiométriques
II- Bilan de la matière
2-1/ Avancement de la réaction
2-2/ Tableau d'avancement de la réaction
2-3/ Le réactif limitant
III- Exercices
3-1/ Exercice 1
3-2/ Exercice 2
3-3/ Exercice 3
3-4/ Exercice 4
I- Modélisation des transformations chimiques d'un système
1-1/ L'état initial et l'état finale d'un système chimique
Au cours d'une transformation chimique, certaines espèces chimiques disparaissent alors que d’autres apparaissent.
- Les espèces chimiques qui disparaissent totalement ou partiellement sont appelées : les réactifs.
- Les espèces chimiques qui apparaissent sont appelées : les produits de la transformation.
Toute transformation chimique évolue d'un état initial à un état final tout en se déroulant sous une pression et une température données.
On appelle état initial l'état sous lequel se trouve le système au début de la transformation, et état final l'état sous lequel il se trouve à la fin de la transformation.
Pour définir l'état d'un système on doit déterminer :
- Les paramètres physiques qui précisent les conditions d'état comme la pression et la température.
- La quantité de matière ainsi que l'état physique de chaque espèce chimique : liquide, solide, gaz ou bien aqueux.
I- Modélisation des transformations chimiques d'un système
1-2/ Modélisation des transformations chimiques
On modélise toute transformation chimique par un modèle simple qu'on appelle réaction chimique qui peut décrire cette transformation, et qu'on représente par une équation chimique dans laquelle les réactifs et les produits sont représentés par leurs formules :
Réactifs→Produits
Dans une équation chimique les réactifs sont placés à gauches d'une flèche qui désigne le sens de la réaction et les produits à sa droite.
Au cours d’une transformation chimique, il y a conservation des éléments chimiques et de la charge électrique, l’équation doit donc être équilibrée par des nombres appelés coefficients stœchiométriques.
I- Modélisation des transformations chimiques d'un système
1-2/ Modélisation des transformations chimiques
L'équation de la réaction peut ê&e modélisée d'une manière générale de la façon suivante:
α.A+β.B→γ.C+δ.D
- A et B : les réactifs .
- C et D: les produits de la réaction.
- α, β, γ, δ : les coefficients stœchiométriques.
La flèche → indique le sens de la réaction.
I- Modélisation des transformations chimiques d'un système
1-3/ Relation entre quantité de la matière et coefficients stœchiométriques
Les quantités de matière des réactifs entrant dans la réaction et celles des produits qui en résultent sont proportionnelles aux coefficients stœchiométriques :
n(A)α=n(B)β=n(C)γ=n(D)δ
II- Bilan de la matière
2-1/ Avancement de la réaction
Pour suivre l'évolution de la quantité de matière des espèces chimiques qui participent dans une réaction chimique, on utilise l'avancement de la réaction noté x exprimé en moles et qui prend une valeur maximale xmax à la fin de la réaction.
II- Bilan de la matière
2-2/ Tableau d'avancement de la réaction
Le suivi de l'évolution d'une réaction chimique nécessite l'intérêt à trois états :
- L'état initial : la réaction n'a pas encore commencé, l'avancement x est nul
- L'état intermédiaire : il, correspond à un état quelconque au cours de la réaction, l'avancement vaut alors une certaine valeur, notée x.
- L'état final : correspond à la fin de la réaction. L'avancement xf correspond alors à une valeur finale .
Le tableau d'avancement :
| Équation de la réaction | α.A+β.B→γ.C+δ.D | ||||
| États | Avancement | Quantité de matière (en mol) | |||
| État initial | 0 | n0(A) | n0(B) | 0 | 0 |
| État de transformation | x | n0(A)-α.x | n0(B)-β.x | γ.x | δ.x |
| État final | xf | n0(A)-α.xf | n0(B)-β.xf | γ.xf | δ.xf |
L'avancement de la réaction permet de déterminer la composition du système à un instant donné ou à l'état final connaissant sa composition initiale, c'est e qu'on appelle bilan de la matière.
II- Bilan de la matière
2-3/ Le réactif limitant
On appelle réactif limitant le réactif dont la disparition totale empêche la poursuite de la réaction chimique.
Donc le réactif limitant est entièrement consommé à la fin de la réaction.
Pour déterminer le réactif limitant dans le cas d'une d'une réaction générale de type α.A+β.B→γ.C+δ.D, on pose deux hypothèses :
- Si x1max<x2max, alors xmax=x1, dans ce cas c'est le réactif A qui est limitant.
- Si x1max>x2max, alors xmax=x2, dans ce cas c'est le réactif B qui est limitant.
C'est à dire que des deux valeurs possibles, l'avancement maximal correspond à la plus petite.
III- Exercices
3-1/ Exercice 1
On considère la réaction entre le fer Fe(s) et le dioxygène O2(g), il se forme du dioxyde de fer de formule Fe3O4(s).
On fait réagir 223,2g de fer et 128g de O2.
- Écrire l'équation de la réaction.
- Déterminer les quantités de matière initiales des réactifs.
- Dresser le tableau d'avancement de la réaction.
- Déterminer xmax et le réactif limitant.
- Faire le bilan de matière à la fin de la réaction.
- Calculer la masse du dioxygène formée.
- Calculer la masse d'oxyde de fer consommée.
- Est-on dans les proportions stœchiométriques ? Justifier.
Données
Masses molaires : M(Fe)=55,8g/mol ; M(O)=16g/mol
III- Exercices
3-2/ Exercice 2
L’éthanol, liquide incolore, de formule C2H6O brûle dans le dioxygène pur. Il se forme du dioxyde de carbone et de l’eau.
On fait réagir m=2,50g d’éthanol et un volume V=2L de dioxygène.
- Écrire l’équation chimique modélisant la transformation.
- Décrire l’état initial du système (n0 )
- Dresser le tableau d'avancement.
- Calculer l’avancement maximal.
- Quel est le réactif limitant?
- Déterminer la composition, en quantité de matière, du système à l’état final.
Données
Volume molaire dans les conditions de l’expérience : Vm=25 L.mol-1
III- Exercices
3-3/ Exercice 3
Lors de la synthèse de l’aspirine au laboratoire, on utilise 3,3g d’acide salicylique solide C7H6O3 et 7mL d’anhydride acétique C4H6O3 liquide.
L’équation de la réaction s’écrit :
C7H6O3(s)+C4H6O3(l)→C9H8O4(s)+C2H4O2(l)
- Calculer les quantités de ces deux réactifs dans l’état initial.
- Dresser le tableau d’avancement.
- Donner un bilan de matière.
- Déterminer les masses des espèces présentes dans l’état final.
- Quelle masse d’acide salicylique aurait-il fallu utiliser pour que le mélange initial soit stœchiométrique?
Données
Masse volumique de l’anhydre acétique : ρ=1,08 g.L-1
III- Exercices
3-4/ Exercice 4
Le diagramme suivant représente les courbes de l'évolution des quantités de matière des espèces chimiques au cours de la transformation chimique :
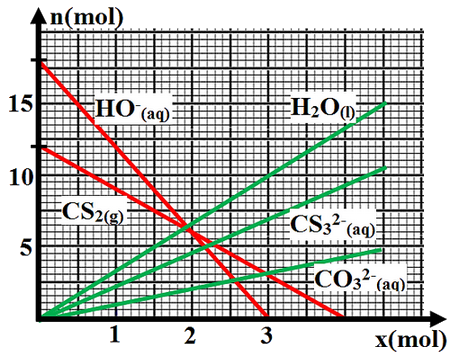
La quantité de matière initiale d'eau (solvant) n'a pas été prise en considération dans le diagramme.
- Identifier les réactifs et les produits de cette transformation.
- Déterminer les quantités de matière initiales des réactifs.
- Détermine le réactif limitant et la valeur de xmax.
- Donner le bilan de matière du système à l’état final.


