
Physique et Chimie : 1ère Année Bac
Séance 20 (Les molécules organiques et les squelettes carbonés)
Professeur : Mr EL GOUFIFA Jihad
Sommaire
I- Les molécules organiques
1-1/ Chaîne carbonée et groupe caractéristique
1-2/ Les chaînes carbonées saturées et insaturées
1-3/ Les chaînes carbonées linéaires, ramifiées et cycliques
1-4/ Représentation des molécules organiques
1-5/ Isomérie de constitution
II- Les alcanes
2-1/ Définition
2-2/ Les alcanes linéaires
2-3/ Les alcanes ramifiés
2-4/ Les cyclo alcanes
III- Alcènes et dérivés éthyléniques
3-1/ Définition
3-2/ Nomenclature des alcènes
3-3/ Isomérie Z et E
3-4/ Test d’identification d’un alcène
IV- Influence de la chaîne carbonée sur les propriétés physiques d’un hydrocarbure
4-1/ Température d’ébullition et de fusion
4-2/ Densité des alcanes
4-3/ Solubilité
4-4/ Application (Distillation fractionnée)
V- Exercices
5-1/ Exercice 1
5-2/ Exercice 2
5-3/ Exercice 3
5-4/ Exercice 4
I- Les molécules organiques
1-1/ Chaîne carbonée et groupe caractéristique
On appelle chaîne carbonée ou squelette carbonée d’une molécule organique, l’enchaînement d’atomes de carbone constituant une molécule organique.
On appelle groupes caractéristiques un groupement d’atomes porté par le squelette carboné et comportant des atomes d’autres éléments que l’hydrogène.
Un groupe caractéristique est un groupe d’atome qui donne des propriétés spécifiques aux molécules qui le possèdent. Les molécules qui possèdent le même groupe caractéristique présentent des propriétés semblables.
I- Les molécules organiques
1-2/ Les chaînes carbonées saturées et insaturées
Lorsque les atomes de carbone ne forment que des liaisons simples entre eux, la chaîne est dite saturée.
Elle est dite insaturée lorsqu’au moins deux atomes de carbone voisins sont liés par une double ou triple liaison.
Exemple

I- Les molécules organiques
1-3/ Les chaînes carbonées linéaires, ramifiées et cycliques
La chaîne carbonée est dite linière lorsque chaque atome de carbone n’est lié qu’à deux autres atomes de carbone au plus.
La chaîne est dite ramifiée lorsqu’un ou des atomes de carbone sont liés à plus de deux autres atomes de carbone.
La chaîne est dite cyclique lorsque tous ses atomes de carbone sont liés à deux autres atomes de carbone au moins.
Exemple

I- Les molécules organiques
1-4/ Représentation des molécules organiques
La formule brute
Elle permet de nous renseigner sur la nature et le nombre des différents atomes constituant la molécule organique.
- Exemple (la formule brute du butane) :
La formule développée plane
Elle montre l’enchaînement des atomes dans la molécule et la nature des liaisons qui les unissent.
- Exemple (la formule développée du butane) :

La formule semi- développée
Elle dérive de la formule développée en supprimant la liaison .
- Exemple (la formule semi-développée du butane) :
L’écriture topologique :
La chaîne carbonée est représentée sous forme d’une ligne brisée, portant éventuellement des ramifications.
Les atomes de carbone et les atomes d’hydrogène qui leurs sont liés ne sont pas indiqués dans cette représentation.
Les liaisons multiples sont représentées par des segments.
- Exemple (la représentation topologique du butane) :

I- Les molécules organiques
1-5/ Isomérie de constitution
Deux composés sont isomères s’ils ont la même formule brute mais des formules développées différentes.
Ils ont des propriétés physiques différentes et des propriétés chimiques très voisines.
On distingue trois isomères :
Les isomères de chaîne
L’enchaînement des atomes de carbone différents.
- Exemple : le butane a deux isomères : une chaîne droite et une ramifiée

Les isomères de position
La position du groupe caractéristique ou d’une liaison multiple sont différents.
- Exemple 1 :

- Exemple 2 :

Les isomères de fonction
La nature du groupe caractéristique est différente.
- Exemple :

II- Les alcanes
2-1/ Définition
Les alcanes sont des hydrocarbures saturés de formule brute , avec est le nombre d’atomes de carbone du squelette carboné.
II- Les alcanes
2-2/ Les alcanes linéaires
Le nom d’un alcane à chaîne linéaire est constitué d’un :
- préfixe qui indique le nombre d’atome carbone de la chaîne (méth, éth, prop…).
- suffixe (terminaison) ane caractérise les alcanes.
| Nombre de carbone de l’alcane | Formule brute | Nom de l’alcane |
| 1 | méthane | |
| 2 | éthane | |
| 3 | propane | |
| 4 | butane | |
| 5 | pentane | |
| 6 | hexane |
II- Les alcanes
2-3/ Les alcanes ramifiés
Le nom d’un alcane ramifié est déterminé en appliquant la règle suivant :
- On cherche la chaîne carbonée la plus longue.
- Ce qui est attaché à cette chaîne s’appelle des groupes alkyles
Exemples :
- : méthyle
- : éthyle
On indique leur place par un indice de position. Celui-ci est obtenu par numérotation des de la chaîne principale, en partant du bout qui donne le plus petit numéro.
Si plusieurs groupes d’alkyles sont identiques on utilise des préfixes di, tri ….
Exemples :

II- Les alcanes
2-4/ Les cyclo alcanes
Le nom d’un cyclo alcane est obtenu à partir du nom de l’alcane correspondant précédé du préfixe cyclo.
Exemples :

III- Alcènes et dérivés éthyléniques
3-1/ Définition
Un alcène est un hydrocarbure présentant une double liaison dans son squelette carboné.
C’est un hydrocarbure insaturé. Sa formule brute est , où est un nombre entier supérieur ou égal à .
On appelle dérivé éthylénique tout composé organique dont la molécule présente au moins une liaison double.
III- Alcènes et dérivés éthyléniques
3-2/ Nomenclature des alcènes
Le nom de l’alcène est établi comme celui de l’alcane correspondant en remplaçant le suffixe « ane » par « ène ».
On numérote la chaîne de façon que le premier atome de carbone de la liaison ait le plus petit numéro possible.
Exemples :

III- Alcènes et dérivés éthyléniques
3-3/ Isomérie Z et E
La position des atomes dans l’espace est différente, cela est dû à ce que la libre rotation est impossible autour de la liaison double , cette isomérie se présente pour le but-2-éne :
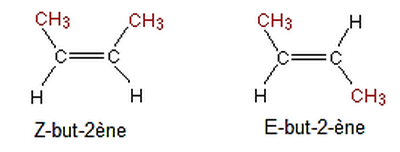
Les groupes sont du même côté (Z-but-2-ène) ou un de chaque côté de la chaîne principale (E-bbut-2-éne).
III- Alcènes et dérivés éthyléniques
3-4/ Test d’identification d’un alcène
On peut mettre en évidence la présence d’un alcène par l’eau de brome, qui perd sa coloration orangée en présence d’un alcène, ce qui traduit une réaction entre l’alcène et l’eau de brome dont l’équation est :
IV- Influence de la chaîne carbonée sur les propriétés physiques d’un hydrocarbure
4-1/ Température d’ébullition et de fusion
Les composés organiques d’une famille n’ont pas la même température d’ébullition, cette température augmente lorsque la longueur de la chaîne carbonée augmente.
Exemples
| Formule brute | Nom de l’alcane | Température d’ébullition à pression atmosphérique |
| méthane | ||
| éthane | ||
| pentane | ||
| hexane |
IV- Influence de la chaîne carbonée sur les propriétés physiques d’un hydrocarbure
4-2/ Densité des alcanes
La densité des alcanes liquides à chaîne carbonée linéaire augmente avec la longueur de leur chaîne carbonée.
Exemples
| Formule brute | Nom de l’alcane | Densité par rapport à l’eau |
| pentane | ||
| hexane | ||
| heptane |
IV- Influence de la chaîne carbonée sur les propriétés physiques d’un hydrocarbure
4-3/ Solubilité
Les hydrocarbures sont des composés insolubles dans l’eau, mais soluble dans des solvants organiques.
La solubilité des alcools, à chaînes carbonées linéaires, dans l’eau diminue avec la longueur de leur chaîne carbonée.
Exemples
| Alcool | Solubilité dans l’eau |
| Se dissout totalement | |
IV- Influence de la chaîne carbonée sur les propriétés physiques d’un hydrocarbure
4-4/ Application (Distillation fractionnée)
Lorsqu’on fait bouillir un mélange de liquide, le liquide qui a la température d’ébullition le plus bas est le premier qui entre en ébullition.
La distillation fractionnée permet de séparer les constituants d’un mélange d’espèces chimiques ayant des températures d’ébullition différentes.
Exemple
La distillation fractionnée du pétrole :

V- Exercices
5-1/ Exercice 1
- Donner les écritures topologiques correspondantes aux formules semi-développées suivantes :

- Donner les formules semi-développées correspondantes aux écritures topologiques suivantes :

V- Exercices
5-2/ Exercice 2
- Préciser le caractère linéaire, ramifié ou cyclique des alcanes dont les formules sont représentées ci-dessous :

- De combien d'atomes de carbone la chaîne carbonée est-elle constituée dans chacun des cas ?
On a représenté ci-dessous les formules de trois composés organiques :

- Donner les noms de ces composés.
- De quel type d'isomérie correspondent les composés (A) et (B) ?
V- Exercices
5-3/ Exercice 3
Le propène réagit avec le dihydrogène, dans des conditions bien déterminées, pour donner un composé saturé.
- Donner la formule semi-développée du propène.
- Écrire l'équation de la réaction en utilisant les formules semi-développées.
- Quel est le nom du produit obtenu ?
V- Exercices
5-4/ Exercice 4
- Écrire la formule semi-développée et l'écriture topologique de l'hydrocarbure ramifié de 5 atomes de carbone, dont l'un n'est lié à aucun atome d'hydrogène.
- Même question pour un hydrocarbure cyclique de 8 atomes de carbone, dont le cycle est constitué de 6 atomes de carbone, et dont 1 atome de carbone n'est lié a aucun atome d'hydrogène.
La formule brute correspond à plusieurs isomères.
- Donner la formule semi-développée de chacun de ces isomères.
- Donner des écritures topologiques correspondant aux formules semi-développées proposées.


