
Physique et Chimie : 1ère Année Bac
Séance 19 (Expansion de la chimie organique)
Professeur : Mr EL GOUFIFA Jihad
Sommaire
I- Introduction à la chimie organique
1-1/ Définition
1-2/ Domaine d'étude de la chimie organique
1-3/ Histoire de la chimie organique
II- Les ressources organiques naturelles
2-1/ La photosynthèse
2-2/ Les synthèses biochimiques
2-3/ Les hydrocarbures fossiles
III- L'élément fondamental de la chimie organique : le carbone
3-1/ Le carbone tétravalent
3-2/ Les liaisons possibles de l’atome de carbone
3-3/ Les différentes écritures de formules
IV- Les isomères
4-1/ Définition
4-2/ Types d’isomères
V- L’importance de la chimie organique dans notre vie quotidienne
I- Introduction à la chimie organique
1-1/ Définition
Historiquement, la chimie organique est la chimie des composés de carbone issues des êtres vivants animal ou végétal, par opposition à la chimie minérale qui s’intéressait aux molécules issues du monde minéral (terre, eau, atmosphère).
Aujourd’hui, la chimie organique est la chimie des composés du carbone d’origine naturelle ou produits par synthèse.
Exemple
- Le méthane et le saccharose ou sucre sont des composés organiques.
- L’eau et l’ammoniac sont des composés minéraux.
I- Introduction à la chimie organique
1-2/ Domaine d'étude de la chimie organique
La chimie organique est la chimie des composés du carbone. Ces composés chimiques peuvent être indifféremment d'origine naturelle ou synthétique.
Les espèces organiques sont constituées d’un nombre limité d’éléments chimiques. Outre le carbone , on rencontre généralement l’élément hydrogène .
Les espèces ne contenant que du carbone et de l’hydrogène sont appelées hydrocarbures.
Toutes les espèces chimiques organiques contiennent donc l'élément carbone (à l’exception des composés tels que , , qui sont toutefois exclus de la chimie organique).
I- Introduction à la chimie organique
1-3/ Histoire de la chimie organique
| Date | Nom du scientifique | Découverte |
| 1828 | Friedrich Wöhler (1800-1882) | Synthèse de l’urée |
| 1856 | William Perkin (1838-1907) Adolf von Baeyer(1837-1917) |
Synthèse de colorants (mauvéine, alizarine, indigo) |
| 1863 | Marcelin Berthelot (1827-1907) | Synthèse de l’acéthylène |
| 1902 | Emile Fischer (1852-1919) | Synthèse des glucides et polypeptides |
| 1973 | Rober Woodward (1917-1979) | Synthèse de la cortisone et de la vitamine B12 |
| 1985 | Harold Kroto | Découverte des fullerènes, molécules en forme de sphères, comportant 60 atomes de carbone |
II- Les ressources organiques naturelles
2-1/ La photosynthèse
Grâce à la chlorophylle, les végétaux sont capables, en utilisant l’énergie solaire, de transformer le carbone minéral (venant de dioxyde de carbone atmosphérique) en carbone organique (dans les glucoses) suivant le bilan :
II- Les ressources organiques naturelles
2-2/ Les synthèses biochimiques
Il s'agit de transformations chimiques effectuées par les cellules des êtres vivants à partir des "aliments".
Les composés organiques sont transformés en d'autres composés organiques.
II- Les ressources organiques naturelles
2-3/ Les hydrocarbures fossiles
Les hydrocarbures fossiles (pétrole et gaz naturel) proviennent de la décomposition d’organismes vivants (végétaux et animaux), lente qui a durée des millions d’années loin de l’air et sous l’action des bactéries.
Les hydrocarbures sont constitués uniquement d'atomes de carbone et d'hydrogène.
II- L'élément fondamental de la chimie organique : le carbone
3-1/ Le carbone tétravalent
Le symbole du noyau de l’atome de carbone est . Sa structure électronique est
La règle de l’octet permet de prévoir que l’atome de carbone établit liaisons covalentes avec les atomes voisins, donc l’atome de carbone est tétravalent.
II- L'élément fondamental de la chimie organique : le carbone
3-2/ Les liaisons possibles de l’atome de carbone
Les quatre liaisons de l’atome de carbone peuvent être distribuées de quatre façons différentes dans l’espace.
Quatre liaisons covalentes simples
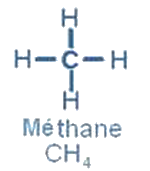
Dans la molécule de méthane , l’atome de carbone forme 4 liaisons covalentes simples avec 4 atomes d’hydrogène, la molécule à la forme d’un tétraèdre régulier.
Une liaison double et deux liaisons simples
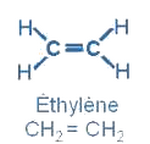
Dans la molécule de l’éthylène , l’atome de carbone forme une liaison covalente double avec l’autre atome de carbone et deux liaisons covalentes simples avec 2 atomes d’hydrogènes, la molécule forme un trigonale plane.
Une liaison triple et une liaison simple
Dans la molécule de l’acétylène , chaque atome de carbone a une liaison triple avec l’autre atome de carbone et une liaison simple avec un atome d’hydrogène, la molécule est linière.

Deux liaisons covalentes doubles
Dans la molécule de dioxyde de carbone , chaque atome de carbone forme une liaison covalente double avec un atome d’oxygène et une liaison covalente double avec l’autre atome de carbone, la molécule est linière.
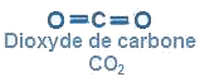
II- L'élément fondamental de la chimie organique : le carbone
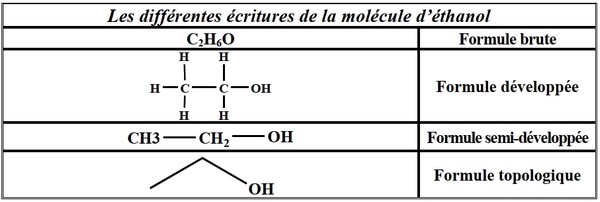
3-3/ Les différentes écritures de formules
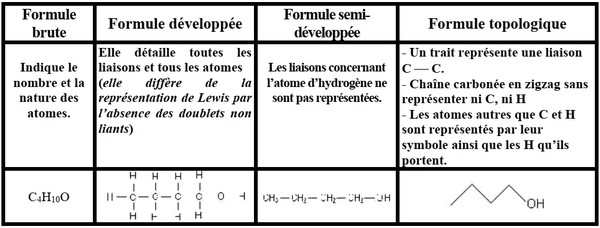
Exemple
IV- Les isomères
4-1/ Définition
En chimie organique, on parle d'isomérie lorsque deux molécules possèdent la même formule brute mais ont des formules développées différentes.
Ces molécules, appelées isomères, peuvent avoir des propriétés physiques, chimiques et biologiques différentes.
IV- Les isomères
4-2/ Types d’isomères
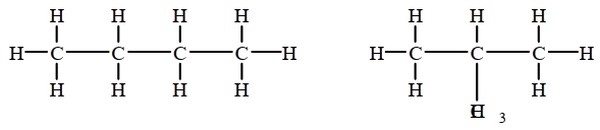
Les isomères de chaîne
les chaînes carbonées sont différentes :
Les isomères de position
la position du groupe fonctionnel ou de la double liaison sont différentes :
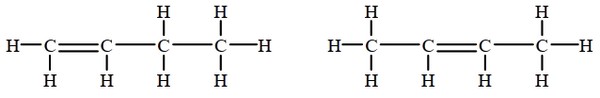
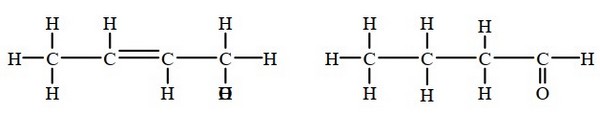
Les isomères de fonction
les groupes fonctionnels sont différents :
V- L’importance de la chimie organique dans notre vie quotidienne
Voici les secteurs industriels les plus dépendants de la chimie organique :
- La chimie lourde, qui assure la fabrication des matières plastiques et du caoutchouc. Cette production en gros tonnages s’effectue en peu d’étapes et à partir de matières premières facilement accessibles.
- La chimie fine, qui élabore des molécules plus complexes et en volume de production plus restreint.
- La parachimie, dont les produits possèdent des propriétés bien connues du grand public (détergents, savons, encres, produits de beauté, colles…)
- La pharmacie, qui élabore les principes actifs des médicaments (analgésiques, antibiotiques, etc)
La synthèse de certains de ces composés s'accompagne aussi de la production d’une quantité importante de déchets (bouteilles, sacs, emballages…) qu’il convient d’éliminer ou de recycler. Aujourd’hui, de nombreux partenaires de l’industrie et de la recherche se mobilisent pour développer les activités de recyclage et de retraitement des déchets.


