
Physique et Chimie : 1ère Année Bac
Séance 14 (Les dosages (ou titrages) directs)
Professeur : Mr EL GOUFIFA Jihad
Sommaire
I- Principe d’un dosage
1-1/ Définition d’un dosage
1-2/ Méthodes de dosage
1-3/ Déroulement d’un dosage direct
1-4/ L’équivalence
II- Dosage acido-basique (Dosage par conductimétrie)
2-1/ Manipulation
2-2/ Analyse de la courbe
2-3/ Équivalence
III- Dosage oxydo-réduction (Dosage colorimétrique)
3-1/ Manipulation
3-2/ Repérage de l’équivalence
IV- Exercices
4-1/ Exercice 1
4-2/ Exercice 2
4-3/ Exercice 3
4-4/ Exercice 4
I- Principe d’un dosage
1-1/ Définition d’un dosage
Doser (ou titrer) une espèce chimique en solution, c’est déterminer sa concentration molaire dans la solution considérée.
Lors du titrage, la concentration de l’une des deux solutions doit être connue, et celle de l’autre est à déterminer.
La solution de concentration connue est appelée solution titrante, l’autre est appelée solution titrée.
I- Principe d’un dosage
1-2/ Méthodes de dosage
Dosage non destructif
Ce type de dosage ne modifie pas la solution dosée, donc cette solution peut être utilisée une autre fois.
On utilise des grandeurs physiques dont la valeur ne dépend que de la concentration en espèce de la solution : Variation de la conductance G ; Variation de l’absorption de lumière (absorbance)..
Exemple : l’utilisation de la courbe d’étalonnage pour déterminer la concentration d’un soluté en solution.
Dosage destructif
Il se produit, dans ce type de dosage, une transformation chimique de la solution dosée, ce qui entraîne la destruction de cette solution.
I- Principe d’un dosage
1-3/ Déroulement d’un dosage direct
On verse à l’aide de la burette la solution titrante dans la solution à titrer.
Il se produit alors une réaction de dosage qui met en jeu le réactif titré et le réactif titrante ,Celle-ci peut être soit acido-basique, soit d’oxydoréduction.
Pour qu’une réaction chimique soit utilisée comme réaction de dosage, il faut qu’elle soit :
- Univoque : il faut que les deux réactifs, titré et titrant, réagissent selon une seule et unique réaction.
- Totale : Un des deux réactifs mis en présence doit disparaître complètement.
- Rapide : atteint son état final rapidement
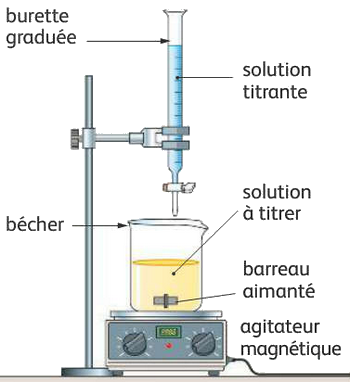
I- Principe d’un dosage
1-4/ L’équivalence
L’étude de la réaction du dosage permet la détermination de la concentration cherchée.
À l’équivalence les deux réactifs titré et titrant sont consommés totalement.
L’objectif principal du dosage c’est le repérage de l’équivalence. On peut repérer l’équivalence à l’aide du :
- Changement du couleur du milieu réactionnel.
- Changement de couleur de l’indicateur coloré ajouté au milieu réactionnel avant le dosage.
- Traçage de la courbe de l’évolution de la conductance du milieu réactionnel.
II- Dosage acido-basique (Dosage par conductimétrie)
2-1/ Manipulation
Expérience
Le bécher contient un volume d’une solution d’acide chlorhydrique de concentration inconnu.
On met la cellule conductimétrique dans le bécher pour mesurer la conductance de la solution.
On remplit une burette par une solution d’hydroxyde de sodium de concentration :
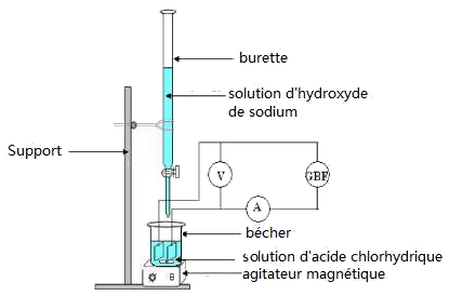
Tableau de résultats

Courbe
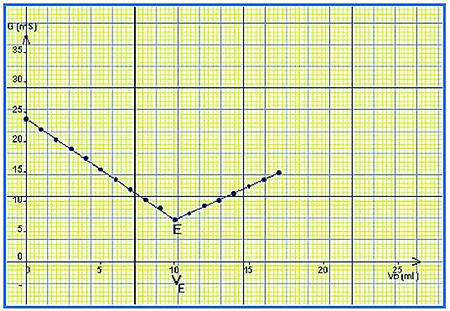
II- Dosage acido-basique (Dosage par conductimétrie)
2-2/ Analyse de la courbe
La courbe est formée de deux portions de droites qui se coupent en un point d’abscisse .
Avant l’équivalence
: Le réactif limitant est .
Dans le bécher les ions disparus sont remplacés par les ions apportés par la solution d’hydroxyde de sodium.
Puisque , la conductance diminue.
Après l’équivalence
: le réactif limitant est , et est totalement consommé.
Les ions et apportés par la solution basiques ajoutée ne sont plus consommés, et la conductance augmente.
À l’équivalence
La conductance est minimale.

II- Dosage acido-basique (Dosage par conductimétrie)
2-3/ Équivalence
Tableau d’avancement de la réaction de dosage :

À l’équivalence, la quantité de matière initiale des ions est égale à la quantité de matière des ions ajoutés :
III- Dosage oxydo-réduction (Dosage colorimétrique)
3-1/ Manipulation
Expérience
La burette contient une solution de permanganate de potassium acidifiée de concentration .
Le bécher contient un volume d’une solution de sulfate de fer II de concentration :
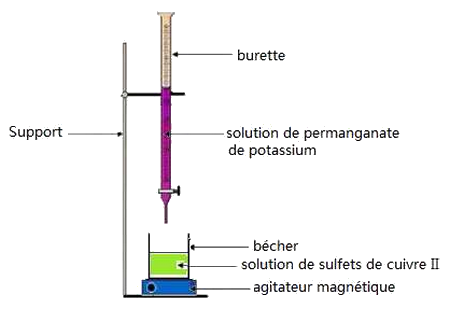
Tableau d'avancement
On appelle la quantité de matière des ions initiale et la quantité de matière ajoutée de la burette :

III- Dosage oxydo-réduction (Dosage colorimétrique)
3-2/ Repérage de l’équivalence
L’équivalence est atteinte lorsque les réactifs (espèce titrée et espèce titrante) ont été mélangés dans les proportions stœchiométriques :
Le repérage de l’équivalence se fait grâce au changement de couleur de la solution contenue dans le bécher.
- Avant l’équivalence :
le réactif limitant est la solution titante , il disparait totalement.
La couleur de la solution dans le bécher est celle de la solution titrée (vert pour ) et les espèces produites (rouille pour incolore pour ).
La couleur de la solution dans le bécher est rouille.
- Après l’équivalence :
le réactif limitant est la solution titrée, il disparait totalement.
La couleur de la solution dans le bécher est celle de la solution titrante (violet).
La couleur de la solution dans le bécher est violette.
IV- Exercices
4-1/ Exercice 1
On dose, par titrage conductimétrique, un volume de la solution d'acide nitrique de concentration par une solution d'hydroxyde de sodium de concentration .
Le suivi du titrage par conductimétrie permet de tracer le graphe suivant :
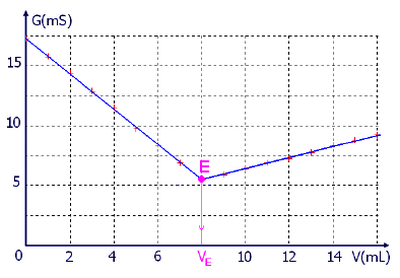
- Faire un schéma légendé du dispositif de titrage.
- Établir l’équation de la réaction de dosage.
- Établir un tableau d’avancement.
- Déterminer la relation d’équivalence.
- Déterminer le volume équivalent du titrage.
- Déterminer la concentration de la solution d'acide nitrique.
IV- Exercices
4-2/ Exercice 2
Pour déterminer la concentration en diode d’une solution de Tarnier, on dose un volume de solution de Tarnier par une solution de thiosulfate de sodium de concentration .
Le volume versé à l’équivalence est égal à .
- Établir l’équation de la réaction de dosage.
- Établir un tableau d’avancement.
- Déterminer la relation d’équivalence.
- Déterminer la concentration de la diode.
Données :
- Couples oxydant / réducteur mis en jeu :
IV- Exercices
4-3/ Exercice 3
Un détartrant pour cafetière vendu dans le commerce se présente sous la forme d’une poudre blanche : l’acide sulfamique qui, en solution, à les mêmes propriétés que l’acide chlorhydrique et que l’on notera HA.
On dissous de ce détartrant dans de l’eau distillée à l’intérieur d’une fiole jaugée de volume que l’on complète jusqu’au trait de jauge. On dispose alors d’une solution de concentration en acide .
On dose de par une solution aqueuse d’hydroxyde de sodium de concentration .
Le graphique donnant la conductance de la solution en fonction du volume de solution d’hydroxyde de sodium versé est le suivant :
On donne les équations des réactions suivantes :
- Réaction de dissolution de HA dans l’eau : .
- Réaction support du dosage : .
- Dresser le tableau permettant de suivre l’évolution du dosage en fonction de l’avancement .
- Définir l’équivalence du dosage. Quelle relation peut-on écrire entre les différentes quantités de réactifs à l’équivalence ?
- Comment peut-on déterminer graphiquement le volume de solution d’hydroxyde de sodium versé à l’équivalence ?
- Déterminer graphiquement . En déduire la concentration de la solution .
- Calculer la masse d’acide sulfamique présente dans .
- En déduire le pourcentage massique de cet acide dans le détartrant étudié.
Données :
- Masse molaire moléculaire de l’acide sulfamique :
IV- Exercices
4-4/ Exercice 4
On prélève un volume de lait (solution ) et on les introduit dans une fiole jaugée de volume . On complète avec de l’eau distillée et on homogénéise pour obtenir une solution , de concentration .
- Quel rapport existe entre la concentration de la solution et la concentration de la solution ?
On verse un volume de la solution dans un bécher et on y ajoute environ d’eau distillée.
- Indiquer précisément le protocole à suivre pour prélever de solution .
On plonge ensuite dans le bécher une cellule conductimétrique. Initialement et après chaque ajout, mL par mL, d’une solution aqueuse de nitrate d’argent de concentration , on détermine la conductivité du milieu réactionnel.
- Indiquer, sur un schéma annoté, le dispositif expérimental à mettre en place.
Le suivi conductimétrique du dosage permet d’obtenir la courbe d’évolution de la conductivité du milieu réactionnel en fonction du volume de la solution de nitrate d’argent versé :
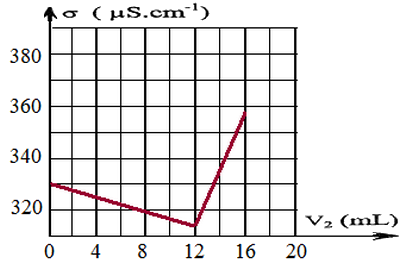
La transformation chimique, rapide, met uniquement en jeu les ions chlorure et les ions argent selon l’équation de réaction :
- Quelle est l’origine de la conductivité initiale de la solution ?
- En utilisant les valeurs des conductivités molaires ioniques données ci-dessous, interpréter la variation de la valeur de la conductivité du milieu réactionnel au cours du dosage.
- Quel événement correspond au point particulier apparaissant sur la courbe ?
- Déterminer, en utilisant cette courbe, le volume de solution de nitrate d’argent versé à l’équivalence.
- Quelle est à l’équivalence la relation entre la quantité de matière en ions argent introduits et la quantité de matière en ions chlorure initialement présents ?
- En déduire la concentration molaire en ions chlorure initialement présents dans la solution , puis celle dans le lait.
La masse d’ions chlorure présents dans un litre de lait doit être comprise entre et .
- Calculer la masse d’ions chlorure présents dans le lait étudié et conclure.
Donnée :
- Masse molaire des ions chlorure : .


