
Physique et Chimie : 3ème Année Collège
Examen Local 5
Professeur : Mr El GOUFIFA Jihad
I- Exercice 1 (8 pts)
- Compléter les phrases suivantes par les mots et les formules convenables de la liste suivante :
Poreuse - imperméable - - la rouille - le cuivre - le Zinc - L’étain — dihydrogène - l’eau - dioxyde de carbone - chlorure d’hydrogène - - monoxyde d’azote
L'Alumine est une matière ______________ à l'air, constituée d'oxyde d'aluminium de formule chimique ______________ .
Pour protéger le fer de la ______________ , on le couvre d'une mince couche de certains métaux comme le ______________ et ______________ .
Lors de la combustion complète du polychlorure de vinyle, il y'a production de ______________ , du gaz ______________ et du gaz ______________ .
- Répondre par "Vrai" ou par "Faux" :
L'oxydation du fer dans l'air humide produit une substance appelée oxyde de fer III : ________
La formule chimique de l'oxyde d'aluminium est Al2O3 : ________
Les oxydes d'azote NO et N02 sont considérés comme matières organiques : ________
Les substances organiques contiennent des atomes de carbone et d'hydrogène : ________
Lors de la dilution d'une solution basique son pH augmente : ________
- Cochez la bonne réponse :
A- La combustion complète du polyéthylène PE produit
- et
- uniquement
B- Le polyéthylène PE contient :
- uniquement des atomes de carbone.
- des atomes de carbone et d'hydrogène.
II- Exercice 2 (8 pts)
On place une quantité de laine de fer au fond d'un tube à essai. On verse une solution d'acide chlorhydrique de pH=2. Il se forme un gaz. Lorsque le dégagement gazeux cesse, on détermine à nouveau le pH de la solution, on trouve pH=4.
Pour déterminer la nature du gaz formé ,on approche une allumette enflammée à proximité de l'ouverture du tube, il se produit une détonation.

Pour déterminer la nature des ions au sein de la solution obtenue, on réalise des expériences sur deux échantillons de cette solution (voir les résultats des expériences sur les schémas) :

- Déterminer la nature du gaz formé et la nature des ions mis en évidence en complétant les espaces vides sur les schémas.
- La solution obtenue dans le tube à essai est-elle acide, basique ou neutre ?
- Expliquer l'augmentation de la valeur du pH de la solution.
- Écrire l'équation simplifié de la réaction de précipitation lorsque l'on ajoute une
solution de nitrate d'argent.
- Écrire l'équation simplifié de la réaction de précipitation lorsque l'on ajoute une
solution d'hydroxyde de sodium.
- Écrire l'équation simplifiée de la réaction modélisant l'action de l'acide
chlorhydrique sur le fer.
III- Exercice 3 (4 pts)
On verse 10mL d'une solution d'acide chlorhydrique dans 3 béchers A, B et C.
On verse 90mL d'eau dans le bêcher B et 990mL d'eau dans C.(le schéma ne respecte pas l'échelle des valeurs des volumes). On agite les trois solutions et on mesure leurs pH. On obtient les résultats des mesures dans le désordre : pH=4,6, pH=2,6 et pH=3,6.
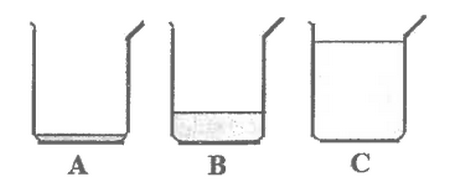
- Préciser la valeur du pH correspondant à chacune des solutions dans les béchers A, B et C en justifiant votre réponse.
- La méthode suivie ne respecte pas une des règles de sécurité. Expliquer le.
La solution du bêcher A agit sur Le métal Aluminium Al (de numéro atomique Z=13) de telle façon que chaque atome perde 3 électrons.
- Remplir la liste suivante correspondant à l'ion d'Aluminium :
- Nombre d'électrons de lion Aluminium : ___________________
- Charge des électrons de l'ion Aluminium : ___________________
- Charge du noyau de l'ion Aluminium : ___________________
- Charge de l'ion Aluminium : ___________________
- Symbole de l'ion Aluminium : ___________________
- Ion monoatomique ou polyatomique : ___________________


