Physique et Chimie : Tronc Commun
Séance 13 (Classification périodique des éléments chimiques)
Professeur : Mr EL GOUFIFA Jihad
Sommaire
I- Les premiers essais de la classification des éléments
1-1/ La découverte des éléments
1-2/ Le premier tableau de Mendeleïev
II- Classification périodique actuelle
III- Les familles chimiques
3-1/ Introduction
3-2/ La famille des alcalins
3-3/ La famille des alcalino-terreux
3-4/ La famille des halogènes
3-5/ La familles des gaz rares ou nobles
IV- Intérêt de la classification périodique
4-1/ Propriétés et place dans la classification
4-2/ Les ions monoatomiques
4-3/ Les molécules
V- Exercices
5-1/ Exercice 1
5-2/ Exercice 2
5-3/ Exercice 3
5-4/ Exercice 4
I- Les premiers essais de la classification des éléments
1-1/ La découverte des éléments
Depuis l’antiquité, on connaît quelques corps simples comme le cuivre, l’or, le fer, l’argent ou le soufre.
En 1700, seuls 12 corps simples (formés d’un seul élément) ont été isolés: l’antimoine, l’argent, l’arsenic, le carbone, le cuivre, l’étain, le fer, le mercure, l’or, le
phosphore, le plomb et le soufre.
Les techniques d’analyse évoluant, le nombre des éléments connus en 1850 est multiplié par 5 : 60 éléments connus.
I- Les premiers essais de la classification des éléments
1-2/ Le premier tableau de Mendeleïev
Mendeleïev (1834-1907) eut l’idée de classer les éléments, connus à son époque, (63 éléments) en colonnes et en lignes par ordre de masses molaires atomiques croissantes, de telles manière que les éléments figurant dans une même ligne présentent des propriétés chimiques semblables.

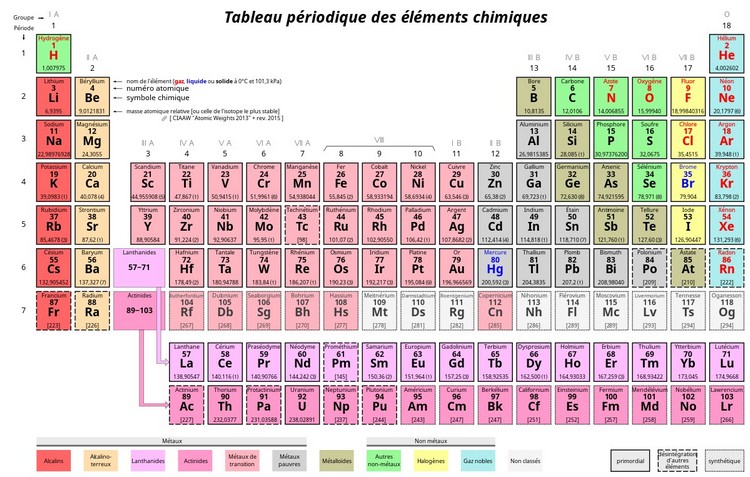
II- Classification périodique actuelle
De nos jours les éléments chimiques sont rangés par numéro atomique croissant.
Les éléments dont les atomes ont le même nombre d’électrons sur leur couche externe sont disposés dans une même groupe.
Les atomes ayant le même nombre de couches électroniques occupées se trouvent sur une même ligne appelé période.
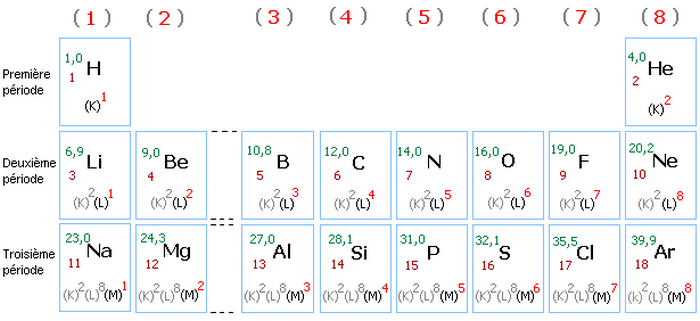
Classification périodique simplifiée (les 18 premiers éléments)
III- Les familles chimiques
3-1/ Introduction
Les atomes des éléments qui appartiennent à une même colonne du tableau périodique constituent une famille chimique.
Ils possèdent le même nombre d’électrons de valence, donc ils ont les mêmes propriétés chimiques.
III- Les familles chimiques
3-2/ La famille des alcalins
Les alcalins sont les éléments de la première colonne du tableau périodique et font donc partie de la famille I.
Cette famille porte ce nom, puisque lorsqu’un de ses éléments est en contact avec de l’eau, la solution formée est basique. Le terme alcalin est un synonyme de basique.
Ces éléments ont tous un seul électron de valence. L’hydrogène ne fait pas partie de la famille des alcalins. Il est toutefois placé au-dessus de la famille des alcalins puisqu'il possède aussi un seul électron de valence.
Propriétés des alcalins
- Ce sont des métaux.
- Ce sont des solides mous; ils peuvent se couper au couteau.
- Ils sont extrêmement réactifs. Pour cette raison, à l’état pur, on doit les conserver dans l’huile puisqu'ils réagissent fortement au contact de l'eau.
- On ne les trouve jamais seuls dans la nature: ils sont toujours liés à d’autres éléments.
- Ils sont de très bons conducteurs d’électricité et de chaleur.

III- Les familles chimiques
3-3/ La famille des alcalino-terreux
Les métaux alcalino-terreux (ou alcalinoterreux)1 sont les six éléments chimiques du 2e groupe du tableau périodique : béryllium , magnésium , calcium , strontium , baryum et radium .
Leurs propriétés sont très semblables : ils sont blanc argenté, brillants, et chimiquement assez réactifs à température et pression ambiantes.
Leur configuration électronique contient une sous-couche s saturée avec deux électrons, qu'ils perdent facilement pour former un cation divalent (état d'oxydation +2).
Leur nom provient du terme « métaux de terre » utilisé en alchimie et décrivant les métaux qui résistent au feu, les oxydes de métaux alcalino-terreux demeurant solides à température élevée.
Propriétés des alcalino-terreux
- Ce sont tous des métaux.
- Ce sont des solides mous, mais moins mous que les alcalins.
- Ils sont réactifs, mais leur réactivité est plus faible que celle des alcalins.
- Ce sont de bons conducteurs d’électricité et de chaleur.
III- Les familles chimiques
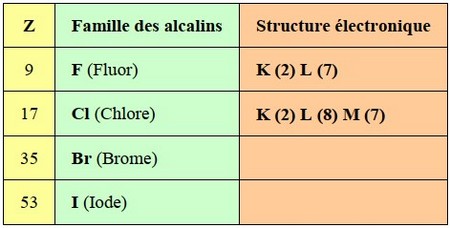
3-4/ La famille des halogènes
Les halogènes sont les éléments de l’avant-dernière colonne du tableau périodique et font donc partie de la famille VII (7).
Ils ont la couleur verte dans le tableau périodique et ont tous sept électrons de valence.
Le mot halogène provient du grec et signifie « engendrer un sel ». En effet, les halogènes sont extrêmement réactifs et forment habituellement des sels avec les alcalins ou les alcalino-terreux avec lesquels ils réagissent.
La famille des halogènes est la seule à posséder des éléments dans chacune des trois phases à la température ambiante (gazeuse : fluor et chlore, liquide : brome, solide : iode et astate).
Propriétés des halogènes
- Ce sont des éléments très colorés.
- Ils sont tous des non-métaux.
- Ils sont extrêmement réactifs. On les retrouve donc toujours liés à d’autres éléments chimiques dans la nature.
- Ce sont des éléments corrosifs.
- Comme ils sont toxiques et bactéricides, on les utilise fréquemment dans des produits désinfectants.
III- Les familles chimiques
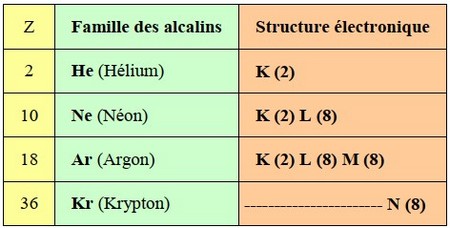
3-5/ La familles des gaz rares ou inertes
Les gaz inertes ou gaz rares sont des éléments de la dernière colonne du tableau périodique et font donc partie de la famille VIII (8).
Ils ont la couleur bleue dans le tableau périodique ci-haut. Ils ont donc huit électrons de valence à l’exception de l’hélium qui n’en possède que deux.
Les gaz inertes portent leur nom dû au fait qu’ils forment tous des gaz à l’état pur, ils sont aussi très peu réactifs (inertes) et sont relativement rares dans l’atmosphère terrestre.
Propriétés des gaz rares
- Ce sont tous des non-métaux.
- Ils sont incolores à l’état naturel.
- Ils produisent de la lumière colorée lorsqu’ils sont soumis à une tension électrique à basse pression.
- Ils ont une très faible réactivité chimique.
IV- Intérêt de la classification périodique
4-1/ Propriétés et place dans la classification
Les propriétés chimiques d’un élément sont liées à sa structure électronique externe.
La structure électronique externe détermine à la fois les propriétés chimiques et la place dans la classification.
IV- Intérêt de la classification périodique
4-2/ Les ions monoatomiques
Les atomes situés dans les colonnes 1, 2, 3 de la classification restreinte ont 1, 2, 3 électrons sur leur couche électronique externe.
Ils peuvent les perdre pour donner des cations portant 1, 2, 3 charges élémentaires.
Exemples :
IV- Intérêt de la classification périodique
4-3/ Les molécules
Les atomes situés dans les colonnes 4, 5, 6, 7 de la classification périodique restreinte ont 4, 5, 6, 7 électrons sur leur couche électronique externe.
Ils peuvent participer à 4, 3, 2, 1 liaisons covalentes pour obtenir 8 électrons sur leur couche électronique externe.
Le nombre de liaisons établies dans une molécule est le même pour tous les atomes d’une famille :
- Pour la famille des halogènes, on retrouve les molécules suivantes : .
- Pour l’oxygène et le soufre : .
- Pour l’azote et le phosphore : .
V- Exercices
5-1/ Exercice 1
L’aluminium est dont le numéro atomique est égal à 13.
- Écrire la formule électronique de l’atome d’aluminium.
- Quelle est sa couche externe ?
- Sur quelle ligne du tableau de la classification périodique se trouve-t-il ?
- A quelle colonne du tableau de la classification périodique appartient-il ?
Le bore est un élément chimique placé juste au-dessus de l’aluminium dans le tableau de la classification périodique.
- En déduire la formule électronique de l’atome de bore et le numéro atomique de cet élément.
Un atome de bore à un nombre de masse .
- Combien comporte-t-il de protons, de neutrons et d’électrons.
V- Exercices
5-2/ Exercice 2
Un atome inconnu engage 3 liaisons covalentes simples au sein d’une molécule, et possède un doublet non liant.
- Déterminer le nombre d’électrons sur la couche externe de cet atome.
La couche électronique externe est la couche M.
- Déterminer la structure électronique, le numéro atomique Z, et identifier l’atome correspondant à l’aide de la classification périodique des éléments.
Cet atome forme 3 liaisons covalentes simples avec des atomes de chlore au sein d’une molécule.
- Donner la formule brute de cette molécule.
- Donner la formule brute de molécule si on remplace cet atome par l’élément azote N. Justifier.
V- Exercices
5-3/ Exercice 3
On donne les schémas de Lewis des trois inconnus tel que X appartient à la seconde période de la classification, Y à la troisième période et A à la première période :

- Écrire leur formule électronique.
- Quels sont les nombres de charges et les noms des atomes X, Y et A ?
Données: H (Z=1), C (Z=6), He (Z=2), O (Z=8), F (Z=9), P (Z=15), Si (Z=14).
V- Exercices
5-4/ Exercice 4
L’atome de magnésium Mg se trouve dans deuxième colonne et la troisième période.
- Donner le numéro atomique Z de cet atome.
- Établir la configuration électronique de l’atome de magnésium.
- À l’aide du tableau de la classification périodique, donner le nom et le symbole de trois éléments chimiques appartenant à la même colonne que le magnésium.
- Combien d’électrons possède chacun de ces éléments sur leur couche externe ?
- En déduire le nom de la famille chimique à laquelle appartient le magnésium.
- En déduire la représentation de Lewis de ces éléments.
- Établir la configuration électronique de l'atome situé juste au-dessus de l'atome de magnésium.
- Donner sa représentation de Lewis.
- Établir la configuration électronique de l'élément situé juste à la gauche du magnésium.
- À quelle famille appartient-il ?
- Donner sa représentation de Lewis.