
Physique et Chimie : 2ème Année Bac
Séance 29 (Contrôle de l’évolution d’un système chimique)
Professeur : Mr El GOUFIFA Jihad
Sommaire
I- Introduction
II- Synthèse d’un ester à partir d’un anhydride d’acide
2-1/ Anhydride d’acide
2-2/ La synthèse d’ester (Estérification rapide)
2-3/ Estérification basique d’un ester
III- Réaction de saponification
3-1/ Définition
3-2/ Application : Saponification des acides gras
3-3/ Propriétés du savon
IV- Influence d'un catalyseur sur l'évolution d'un système chimique
4-1/ Définition
4-2/ Catalyses homogène, hétérogène et enzymatique
V- Exercices
5-1/ Exercice 1
5-2/ Exercice 2
5-3/ Exercice 3
5-4/ Exercice 4
I- Introduction
L'estérification et l'hydrolyse sont limitées et lentes même si on peut les accélérer par un excès de réactif, par un catalyseur et en augmentant la température.
Pour améliorer le rendement, on a cherché à rendre la réaction inverse impossible en remplaçant un réactif.
Pour l'estérification , on remplace l'acide carboxylique par un anhydride d'acide de façon à ne pas obtenir d'eau, ainsi l'hydrolyse de cet ester ne peut pas avoir lieu.
De même, pour l'hydrolyse d'un ester, on remplace l'eau par l'ion hydroxyde pour ne pas obtenir un acide carboxylique mais sa base conjuguée (l'ion carboxylate) qui ne réagit pas avec l'alcool formé.
II- Synthèse d’un ester à partir d’un anhydride d’acide
2-1/ Anhydride d’acide
Les anhydrides d’acide constituent une famille organique, de formule générale :

et sont des chaînes carbonées.
Ils sont obtenus par élimination d’une molécule d’eau des acides carboxyliques correspondants et .
On appelle cette réaction déshydratation :
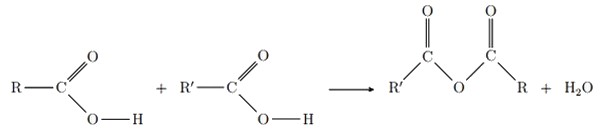
II- Synthèse d’un ester à partir d’un anhydride d’acide
2-2/ La synthèse d’ester (Estérification rapide)
La synthèse des esters à partir des acides carboxyliques est une réaction lente et limitée, elle devient plus rapide et totale lorsque l’acide carboxylique est remplacé par son anhydride :

Cette réaction est rapide et totale (On l’appelle estérification rapide avec l’anhydride de l’acide carboxylique).
Elle peut être accélérée par un chauffage ou par l’utilisation d’un catalyseur.
La transformation se déroule même en absence d’eau, on n’a pas d’estérification des esters, et par suite le rendement est plus élevé.
II- Synthèse d’un ester à partir d’un anhydride d’acide
2-2/ La synthèse d’ester (Estérification rapide)
Exemple (Synthèse de l’aspirine)
L'aspirine (ou acide acétylsalicylique) est un ester synthétisé à partir de l'acide salicylique et de l'anhydride éthanoïque :
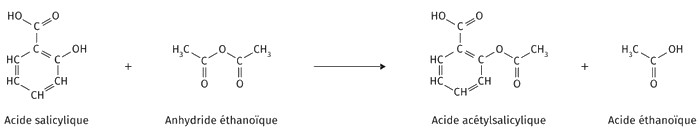
II- Synthèse d’un ester à partir d’un anhydride d’acide
2-3/ Estérification basique d’un ester
L’estérification basique d’un ester est une transformation lente et totale (mais rapide par rapport à celle d’eau) :
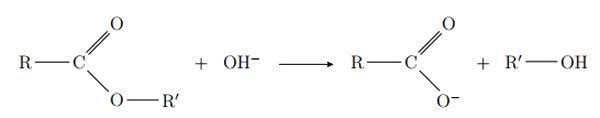
III- Réaction de saponification
3-1/ Définition
La saponification est une réaction chimique transformant un ester en ion carboxylate en alcool :

Il s'agit en fait de l'hydrolyse d'un ester en milieu basique (présence de ).
Cette réaction permet la synthèse du savon.
III- Réaction de saponification
3-2/ Application : Saponification des acides gras
La saponification des corps gras (huiles, graisses...), a une grande importance dans le secteur industriel car il nous permet d’obtenir des esters naturels, les alcools correspondants à la fabrication du savon.
Les acides gras sont des acides carboxyliques ayant des chaînes carbonées longues (Exemple : ).
Préparation d’un savon à partir d’huile alimentaire et de soude
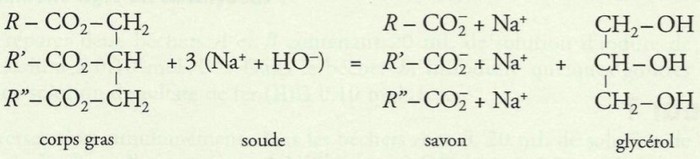
III- Réaction de saponification
3-3/ Propriétés du savon
Le savon est un mélange d'ions carboxylates et d'ions sodium (ou de potassium ) dont les radicaux sont dérivés d’acides gras à longues chaînes carbonées (plus de 10 atomes de carbone).
L'ion carboxylate constituant le savon est une base qui appartient au couple acide/base RCOOH/RCOO- ,il est constitué de deux parties:
- Une tête soluble dans l’eau appelée la partie hydrophile.
- Une longue chaîne carbonée (la queue), insoluble dans l'eau appelée la partie hydrophobe.

Les parties hydrophobes sont solubles dans les huiles et les graisses constituant la saleté du linge.
Ainsi les particules savonneuses peuvent s’enfoncer dans les tâches organiques et les retirer du tissu.

IV- Influence d'un catalyseur sur l'évolution d'un système chimique
4-1/ Définition
Un catalyseur est une substance qui accélère une réaction chimique sans la modifier.
En général, il est régénéré à la fin de la réaction et il n'apparaît pas dans l'équation chimique.
On indique parfois le catalyseur au dessus de la flèche dans l'équation.
Un catalyseur a un rôle purement cinétique : il ne peut modifier ni le sens d’évolution d’un système, ni son état d’équilibre.
Tout catalyseur d’une réaction dans le sens direct est un catalyseur de cette réaction dans le sens inverse.
Ainsi, les ions hydrogène catalysent :
- la réaction d’estérification, mais aussi celle d’hydrolyse des esters.
- l’hydratation des alcènes comme la déshydratation des alcools :

IV- Influence d'un catalyseur sur l'évolution d'un système chimique
4-2/ Catalyses homogène, hétérogène et enzymatique
Lorsque le catalyseur appartient à la même phase que les réactifs, la catalyse est dite homogène.
Lorsque le catalyseur n’appartient pas à la même phase que les réactifs, la catalyse est dite hétérogène.
Lorsque le catalyseur est une enzyme, la catalyse est enzymatique.
Exemple
La catalyse de l'estérification et l'hydrolyse avec l'acide sulfurique est homogène, on le mélange aux réactifs.
V- Exercices
5-1/ Exercice 1
- Écrire l’équation de la réaction de synthèse du butanoate de méthyle avec un acide carboxylique puis avec un anhydride d’acide.
- Quelles sont les différences entre les deux transformations ?
On mélange de méthanol avec d’acide butanoïque et on obtient d’ester.
- Calculer le rendement de la transformation.
- Par quelle masse d’anhydride butanoïque faut-il remplacer l’acide butanoïque pour avoir la même quantité de matière ?
On obtient d’ester par la transformation avec l’anhydride butanoïque.
- Calculer le rendement et conclure.
Donnée :
- Masse volumique du méthanol,
V- Exercices
5-2/ Exercice 2
On utilise de l’huile de palme pour fabriquer certains savons.
Cette huile contient principalement de la palmitine de formule :
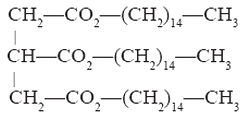
- Écrire l’équation de saponification de la palmitine et donner les caractéristiques intéressantes de cette réaction.
- Comment le savon solide est-il obtenu ?
On introduit de palmitine et de la soude en excès.
Après divers traitement dont la purification, on obtient une masse sèche de savon de .
- Calculer le rendement de la transformation. Commenter.
V- Exercices
5-3/ Exercice 3
La butyrine est un corps gras présent dans le beurre, c’est un triglycéride provenant de la réaction entre le glycérol et l’acide butanoïque (ou butyrique).
- Donner la formule semi-développée de la butyrine.
- Calculer sa masse molaire.
On réalise un montage à reflux en plaçant dans un ballon une masse de butyrine en présence d’un excès d’hydroxyde de sodium.
- Écrire l’équation de la réaction, comment se nomme(nt) le(s) produit(s) obtenu(s) ?
Après refroidissement, on verse le mélange réactionnel dans une solution saturée de chlorure de sodium.
On recueille après séchage un solide pâteux de masse .
- Quel est l’intérêt d’utiliser une solution saturée de chlorure de sodium ?
- Comment se nomme cette opération ?
- Déterminer le rendement de la réaction.
Données :
- Les masses molaires atomiques en g/mol :
- Glycérol : propan-1,2,3-triol.
V- Exercices
5-4/ Exercice 4
On a préparé à partir d’un alcool et d’un acide à chaîne carbonée saturée, un ester de masse molaire .
- Quelle est sa formule brute ? En déduire toutes les formules semi-développées possibles.
Pour identifier cet ester, on en saponifie . On obtient après acidification de la solution deux composés A et B.
Par distillation du mélange ainsi obtenu, on récupère une masse .
B peut facilement être oxydé en cétone par une solution acide de permanganate de potassium.
- Quelle est la nature chimique de B ?
- En admettant que toutes les étapes de la synthèse ont un rendement de 100%, quelle quantité de B obtient-on ?
- En déduire sa masse molaire, sa formule brute et sa formule semi-développée.
- Identifier alors l’ester E et écrire l’équation de sa saponification.


