
Physique et Chimie : 2ème Année Bac
Séance 21 (Transformations spontanées dans les piles et production d'énergie)
Professeur : Mr El GOUFIFA Jihad
Sommaire
I- Pile électrochimique
1-1/ Transfert des électrons
1-2/ Définition d’une pile électrochimique
II- La pile Daniell
2-1/ Description
2-2/ Fonctionnement
2-3/ Réaction aux électrodes
2-4/ Rôle du pont salin
2-5/ Schéma conventionnel
2-6/ Généralisation
III- Étude quantitative d'une pile
3-1/ Quantité d’électricité débitée par une pile pendant une durée ∆t
3-2/ Capacité d’une pile
IV- Exemples de piles usuelles
V- Exercices
5-1/ Exercice 1
5-2/ Exercice 2
5-3/ Exercice 3
I- Pile électrochimique
1-1/ Transfert des électrons
Transfert spontané direct
Lorsque les espèces chimiques participants à une réaction d’oxydoréduction en solution aqueuse mélangées, il se produit un transfert spontané et direct d’électrons du réducteur vers l’oxydant.
Transfert spontané indirect
Lorsque les espèces chimiques participants à une réaction d’oxydoréduction sont séparées, on peut réaliser un transfert d’électrons spontané et indirect du réducteur vers l’oxydant, par l’intermédiaire d’un conducteur métallique.
Les piles fonctionnent sur ce principe.
I- Pile électrochimique
1-2/ Définition d’une pile électrochimique
Un dispositif qui permet d’obtenir du courant électrique grâce à une réaction chimique spontanée est une "pile électrochimique".
Une pile électrochimique est constituée de deux compartiments distincts contenant chacun un couple oxydant / réducteur qui sont reliés par un pont salin (ou séparée par une paroi poreuse).
Chaque compartiment d’une pile constitue une demi-pile.
Une demi-pile est constituée d’une plaque de métal , appelée électrode, qui plonge dans une solution électrolytique contenant l’ion métallique associé au métal .
Autrement dit chaque demi-pile contient l’oxydant et le réducteur d’un couple.
Remarque : le cas où l’oxydant et le réducteur du couple sont sous forme ionique, l’électrode est inerte et ne sert qu’au transfert des électrons.
Le pont salin fait le lien entre les deux demi-piles, il est constitué d’un électrolyte (solution de chlorure de potassium ou nitrate d’ammonium).
II- La pile Daniell
2-1/ Description
La pile Daniell est constituée de deux compartiments liés par un pont salin.
Le premier compartiment se compose d'une plaque de cuivre plongée dans une solution de sulfate de cuivre , ce qui constitue la 1ère demi-pile qu'on appelle électrode.
Le deuxième compartiment se compose d'une plaque de zinc plongée dans une solution de sulfate de zinc , c'est l'autre demi-pile qu'on appelle aussi électrode.
Le pont salin (ou ionique) qui relie les deux solutions il est constitué d'une solution de chlorure de potassium qui est un conducteur électrolytique.
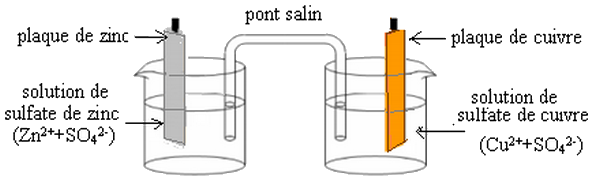
II- La pile Daniell
2-2/ Fonctionnement
Dès la fermeture de l’interrupteur, l’ampèremètre indique le passage d’un courant de la borne correspondant au cuivre vers la borne correspondant au zinc .
L’apparition d’un dépôt de cuivre sur l’électrode de cuivre et la diminution progressive de la masse de l’électrode de zinc témoigne d’une réaction chimique qui se déroule dans la pile.
Les électrons qui circulent à travers le circuit extérieur sont libérés, au niveau de l’électrode de la demi-pile renfermant le couple redox , par les atomes de zinc qui s’oxydent en ions et sont captés par les ions cuivre qui se réduisent en Cu atomique au niveau de l’électrode de la demi-pile renfermant le couple redox .
Les transformations qui se produisent effectivement dans chaque demi-pile sont :
- au niveau de la lame de cuivre : (réduction).
- au niveau de la lame de zinc : (oxydation).
La réaction spontanée qui se produit quand la pile débite du courant est représentée par l’équation :
II- La pile Daniell
2-3/ Réaction aux électrodes
Dans chaque demi-pile, un processus d’oxydation ou de réduction a lieu sur l’électrode.
Il est nommé réaction d’électrode.
L’électrode qui est le siège d’une réduction est appelée cathode.
L’électrode qui est le siège d’une oxydation est appelée anode.
On dit qu’il y a réduction cathodique et oxydation anodique.
II- La pile Daniell
2-4/ Rôle du pont salin
Le pont salin (solution ionique (K+, Cl-) gélifiée) assure la neutralité électrique des deux solutions grâce à la migration des ions.
Si on enlève le pont salin il est normal que le courant ne passe plus dans le circuit extérieur puisque le circuit est ouvert.
Le rôle du pont salin est donc d’assurer la continuité électrique du circuit entre les deux compartiments de la pile sans introduire de nouveaux couples redox et d’empêcher le mélange des solutions se trouvant dans les deux compartiments.
II- La pile Daniell
2-5/ Schéma conventionnel
On peut symboliser une pile par la chaîne conductrice qui la constitue.
Un Slash symbolise l’interface entre l’électrode solide conductrice et la solution électrolytique dans une demi-pile.
Deux Slash symbolisent le pont salin entre les deux piles.
Le pôle (+) de la pile est placé à droite, et le pôle (-) à gauche :
Dans le cas de la pile Daniell :
III- Étude quantitative d'une pile
3-1/ Quantité d’électricité débitée par une pile pendant une durée
Pendant une durée , électrons de charge élémentaire circulent à travers une section de conducteur.
La charge totale qui a traversé la section est :
La quantité de matière d’électrons transférés lorsque la pile débite avec est la constante d’Avogadro.
Donc :
Le produit est une constante appelée le Faraday, notée .
Un faraday correspond à la valeur absolue de la charge d’une mole d’électrons : .
Et d’après la définition du courant électrique qui est débité par la pile pendant une durée :
III- Étude quantitative d'une pile
3-2/ Capacité d’une pile
La capacité d’une pile est la quantité d’électricité maximale qu’elle peut fournir avant d’être usée.
De façon générale, une pile est usée lorsque le réactif limitant a été complètement consommé :
IV- Exemples de piles usuelles
| Pile saline | Pile alcaline | |
| Anode | Récipient de zinc | Poudre de zinc (collecteur : Tige métallique) |
| Cathode | Dioxyde de manganèse MnO2 + poudre de carbone (collecteur : Graphite) | Dioxyde de manganèse MnO2 + poudre de carbone (collecteur : Récipient en acier) |
| Électrolyte | Chlorures d'ammonium et de zinc gélifiés (composé ionique appelé autrefois sel d'où le nom de Saline) | Solution aqueuse d'hydroxyde de potassium (Potasse) (le potassium étant un Métal Alcalin d'où le nom d'Alcaline) |
| Milieu | Acide | Basique |
| Espèces chimiques présentes | ||
| FEM | 1,5 V | 1,5 V |
| Schéma |
V- Exercices
5-3/ Exercice 3
À l’aide d’un pont salin au chlorure de potassium, on réalise la pile dont la réaction associée est :
La constante d’équilibre de cette réaction est .
Les concentrations initiales en ions et sont :
.
- Schématiser avec toutes précisions nécessaires cette pile.
- Préciser en le justifiant la polarité des deux électrodes.
- Donner le symbole de cette pile.
- Quel est le rôle du pont salin ? Peut-on le remplacer par un fil conducteur en cuivre ?
On relie les deux électrodes de cette pile à un résistor.
- Préciser en justifiant le sens dans lequel va évolué spontanément la réaction précédente ? En déduire l’équation de la réaction spontanée qui se produit dans la pile.
À partir de l’instant initial , on relie les deux électrodes de cette pile à un conducteur ohmique et on laisse la pile fonctionner suffisamment longtemps jusqu’à l’ instant où les ions sont consommés.
- Déterminer à cet instant les valeurs des concentrations et .
Partant des conditions initiales de la question précédente (6), on ajoute quelques millilitres d’eau distillée dans le compartiment où il y’a les ions .
- La pile re-débite-t-elle du courant ? Si oui, dans quel sens ? Justifier.
V- Exercices
5-1/ Exercice 1
On réalise une pile en utilisant le matériel et les produits suivants :
- un bêcher contenant le volume d’une solution aqueuse de nitrate d’argent de concentration molaire .
- un bêcher contenant le volume d’une solution aqueuse de nitrate de cuivre de concentration molaire .
- un fil de cuivre ; un fil d’argent.
- un pont salin contenant une solution aqueuse saturée de nitrate de potassium .
On relie les électrodes de la pile à un conducteur ohmique en série avec un ampèremètre, et on observe le passage d’un courant électrique dans le circuit extérieur de la pile.
- Calculer la valeur du quotient de la réaction Qr,i dans l’état initial du système chimique.
- En déduire le sens spontané de l’évolution de ce système.
On fait fonctionner la pile pendant une longue durée jusqu’ ce qu’il s’épuise.
- Déterminer la valeur de la quantité d’électricité qui traverse le conducteur ohmique depuis le début de fonctionnement de la pile jusqu'à son épuisement, sachant que le réactif limitant est l’ion .
Données :
- Constante de Faraday :
- Constante d’équilibre associée à l’équation : est .
V- Exercices
5-2/ Exercice 2
On réalise la pile Cuivre – Aluminium en reliant deux demi-piles par un pont salin de chlorure d’ammonium .
La première demi- pile est constituée d’une lame de cuivre partiellement immergée dans une solution aqueuse de sulfate de cuivre II de concentration et de volume .
La deuxième demi-pile est constituée d’une lame d’aluminium partiellement immergée dans une solution aqueuse de chlorure d’aluminium de même concentration et de même volume .
On branche entre les pôles de la pile un conducteur Ohmique , un ampèremètre et un interrupteur :
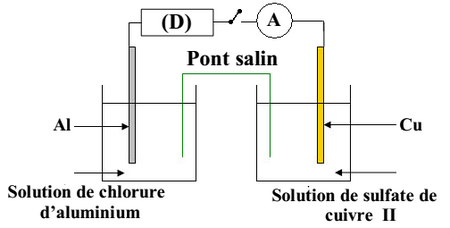
À l’instant on ferme le circuit, un courant électrique d’intensité constante circule alors dans le circuit.
La courbe suivante représente la variation de la concentration des ions cuivre II existant dans la première demi-pile en fonction du temps :
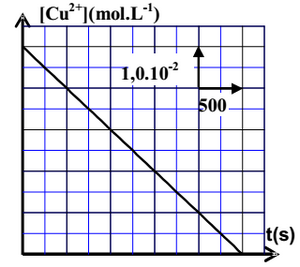
- En utilisant le critère d’évolution spontanée, déterminer le sens d’évolution du système chimique constituant la pile.
- Donner la représentation conventionnelle de la pile étudiée.
- Exprimer la concentration à un instant en fonction de , , , et .
- En déduire la valeur de l’intensité du courant électrique qui passe dans le circuit.
La pile est entièrement usée à une date .
- Déterminer, en fonction de , , et , la variation de la masse de la lame d’aluminium lorsque la pile est entièrement usée.
- Calculer .
Données :
- Constante de Faraday :
- Masse molaire atomique de l’élément aluminium : .
- Constante d’équilibre associée à l’équation : est .


