
Physique et Chimie : 3ème Année Collège
Semestre 1 Devoir 3 Modèle 1
Professeur : Mr El GOUFIFA Jihad
Exercice 1 (5 pts)
- Compléter les phrases suivantes :
a- L’acide chlorhydrique réagit avec les métaux : _____________ et _____________ et le _____________ mais ne réagit pas avec _____________ .
b- Lorsque L’acide chlorhydrique réagit avec les métaux il se forme un gaz explosif, c’est _____________ , et des ions métalliques.
c- Pour prouver la présence des ions positifs on ajoute _____________ .
d- On prouve la présence des ions chlorure par la solution _____________ .
- Répondre par "Vrai" ou "Faux"
a- L'hydroxyde de cuivre est un précipité vert : __________
b- Le fer réagit avec l’acide chlorhydrique et ne réagit pas avec la soude : __________
c- L’ion Ag+ est un réactif qui permet d’identifier et : __________
d- La formule de la Solution d’hydroxyde de sodium est : __________
Exercice 2 (5 pts)
On introduit deux plaques X et Y dans deux béchers contenant une solution d'acide chlorhydrique.
On observe l’émission d’un gaz dans le bécher où se trouve la plaque X, par contre il ne se produit rien dans l’autre bécher.
- Donner le nom du métal qui constitue la plaque Y.
- Donner le nom du gaz produit.
On ajoute des gouttes de solution de soude dans le bécher ou il y a la plaque X et on remarque la formation d'un précipité vert.
- Préciser le nom d’ion identifier.
- En déduire le métal formant la plaque X.
- Écrire l'équation bilan de la réaction de la plaque X avec la solution d'acide chlorhydrique et l’équation simplifié.
Exercice 3 (7 pts)
Ahmed a versé quelques gouttes d’une solution d’acide chlorhydrique dans un tube à essai contenant le zinc.
Il a observé un dégagement gazeux et la formation d’une solution A :
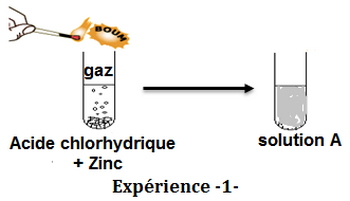
- Donner la formule ionique de la solution d’acide chlorhydrique.
- Quel est le nom du gaz produit ? Quelle est sa formule ?
Ahmed mis la solution A obtenue dans l’expérience 1 dans deux tubes à essais 1 et 2, et il a effectué les expériences suivantes :
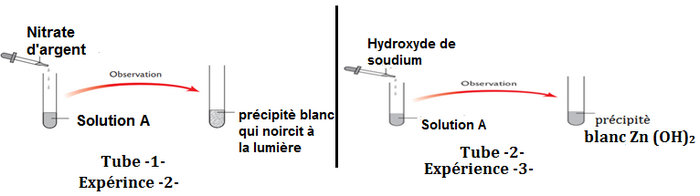
- Quels ions ont été identifiés dans le tube 1 (l’expérience 2) ?
- Écrire l’équation de précipitation dans le tube 1 (l’expérience 2)
- Quels ions ont été identifiés dans le tube 2 (l’expérience 3) ?
- Donner le nom du précipité blanc .
- Écrire l’équation de précipitation dans le tube 2 (l’expérience 3).
- Écrire l'équation bilan de la réaction du zinc avec l'acide chlorhydrique (l’expérience 1).
- Écrire l'équation simplifié de la réaction du zinc avec l'acide chlorhydrique (l’expérience 1).
Exercice 4 (3 pts)
Basma et son amie ont trouvé au laboratoire une solution aqueuse dans un flacon en plastique sans étiquette.
Pour déterminer le nom et la formule chimique de cette solution , elles ont effectué les expériences suivantes:
- Expérience 1: elles ont ajouté une solution d'hydroxyde de sodium à la solution et ont obtenu un précipité bleu.
- Expérience 2: elles ont ajouté une solution de nitrate d'argent à la solution et ont obtenu un précipité blanc qui noircit avec la lumière.
- Quel est l'ion qui a été identifié dans l’expérience 1 ? écrire l’équation de cette précipitation.
- Quel est l'ion qui a été identifié dans l’expérience 2 ? écrire l’équation de cette précipitation.
- Déduire le nom et la formule ionique de cette solution .


