
Physique et Chimie : 3ème Année Collège
Séance 7 (Réactions de quelques métaux avec les solutions acides et basiques)
Professeur : Mr El GOUFIFA Jihad
Sommaire
I- Introduction
II- Action de l'acide chlorhydrique sur les métaux
2-1/ Expérience
2-2/ Observation
2-3/ Conclusion
2-4/ Remarques
III- Action de l'hydroxyde de sodium (la soude) sur les métaux
3-1/ Expérience
3-2/ Observation
3-3/ Conclusion
IV- Action des solutions acides et basiques sur les matériaux non métalliques
V- Exercices
5-1/ Exercice 1
5-2/ Exercice 2
5-3/ Exercice 3
5-4/ Exercice 4
I- Introduction
Avant d'emballer les solutions acides ou basiques, les producteurs cherchent des matériaux d'emballage convenables qui ne réagissent pas avec ces solutions.
Parmi les solutions les plus fréquentes au quotidien ,on trouve l'acide chlorhydrique et la soude.
- Peut-on conserver et faire l'emballage de ces solutions dans des récipients métalliques ?
- Est ce que ces solutions réagissent avec le plastique et le verre ?
II- Action de l'acide chlorhydrique sur les métaux
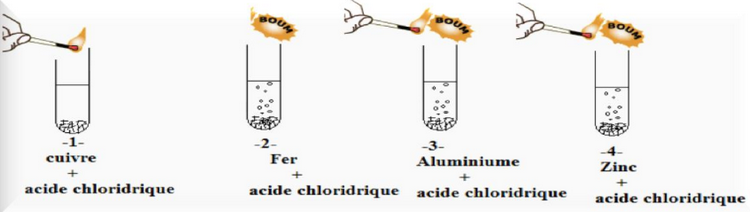
2-1/ Expérience
On ajoute une quantité d'acide chlorhydrique de formule chimique (H++ et de à quatre tubes à essais contient des métaux .
Après quelques minutes ,on approche une allumette enflammée de l'entrée du chaque tube à essais.
II- Action de l'acide chlorhydrique sur les métaux
2-2/ Observation
Avec le cuivre, il ne se passe rien : l'acide chlorhydrique ne réagit pas avec le cuivre.
Lorsqu'on ajoute de l'acide chlorhydrique dans les tubes -2- , -3- et -4- on observe un dégagement gazeux (réaction chimique).
On entend une petite détonation à l'approche de l'allumette enflammée près de l'orifice du tube. La détonation montre qu'il s'est formé un gaz : le dihydrogène.
Lorsqu'on mesure le pH de la solution on voit que la valeur a augmenté.
II- Action de l'acide chlorhydrique sur les métaux
2-3/ Conclusion
Tube 1 (Cu)
Dans le tube 1 ou il y a le cuivre, il ne se produit rien, pas de réaction chimique.
Tube 2 (Fe)
Dans le tube 2 l'acide chlorhydrique réagit avec le fer (les réactifs) et cette réaction produit :
- Le gaz de dihydrogène :
- Solution de chlorure de fer :
les ions chlorures Cl− sont des ions spectateurs, n'interviennent pas dans la réaction, On peut donc simplifier l'écriture de l'équation en ne les mentionnant pas :
II- Action de l'acide chlorhydrique sur les métaux
2-3/ Conclusion
Tube 3 (Al)
Dans le tube 3 l'acide chlorhydrique réagit avec l'aluminium (les réactifs) et cette réaction produit :
- Le gaz de dihydrogène :
- Solution de chlorure d’aluminium :
les ions chlorures Cl− sont des ions spectateurs, n'interviennent pas dans la réaction, On peut donc simplifier l'écriture de l'équation en ne les mentionnant pas :
II- Action de l'acide chlorhydrique sur les métaux
2-3/ Conclusion
Tube 4 (Zn)
Dans le tube 2 l'acide chlorhydrique réagit avec le zinc (les réactifs) et cette réaction produit :
- Le gaz de dihydrogène :
- Solution de chlorure de zinc :
les ions chlorures Cl− sont des ions spectateurs, n'interviennent pas dans la réaction, On peut donc simplifier l'écriture de l'équation en ne les mentionnant pas :
II- Action de l'acide chlorhydrique sur les métaux
2-4/ Remarques
Tous les métaux et alliages ne sont pas attaqués par tous les acides.
L'or (Au), l'argent (Ag) le cuivre (Cu)... ne réagissent pas avec l'acide chlorhydrique par contre peuvent réagir avec d'autres solutions ainsi, le cuivre réagit avec l'acide nitrique.
La réaction entre un métal et l'acide chlorhydrique lorsqu'elle a lieu produit du dihydrogène et des ions métalliques .
D'une manière générale on peut écrire :
III- Action de l'hydroxyde de sodium (la soude) sur les métaux
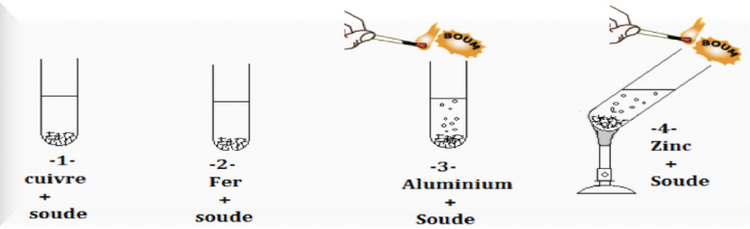
3-1/ Expérience
On ajoute une quantité de soude à quatre tubes à essais contint des métaux (Zn, Al, Cu, Fe) ;
On approche une allumette enflammée de l'entrée du tube à essais :
III- Action de l'hydroxyde de sodium (la soude) sur les métaux
3-2/ Observation
La soude ne réagit pas avec le fer et cuivre.
L'aluminium réagit rapidement avec la soude alors que la réaction du zinc est plus lente, elle nécessite un chauffage.
L'action de la soude sur l'aluminium et le zinc entraîne la formation du gaz dihydrogène (provoque une détonation à proximité d'une flamme).
III- Action de l'hydroxyde de sodium (la soude) sur les métaux
3-3/ Conclusion
La solution de soude réagit avec le zinc et l'aluminium selon les bilans des réactions suivant :
- Cas du zinc :
- Cas d'aluminium :
IV- Action des solutions acides et basiques sur les matériaux non métalliques
Les matières plastique ne réagissent pas en général avec les solutions acides et basiques.
Les acides et les bases peuvent être stockés dans des récipients plastiques ou en verre.
V- Exercices
5-1/ Exercice 1
complétez les réactions suivantes :
Fer + acide chlorhydrique --> _____________ + _____________
_____________ + acide chlorhydrique --> _____________ + chlorure de Zinc
V- Exercices
5-2/ Exercice 2
Une élève verse des gouttes de solution d’acide chlorique dans un tube à essai contenant un peu de limaille de fer et observe une émission de gaz avec la formation d’une solution verte.
- Quel est le nom du gaz produit et comment le détecter ?
- Quels sont les ions responsables de la coloration de la solution en vert et comment les identifier ?
- Écrivez l'équation bilan de la réaction du fer avec la solution d'acide chlorhydrique.
V- Exercices
5-3/ Exercice 3
Une plaque d'aluminium réagit avec une quantité d'acide chlorhydrique en produisant un gaz incolore qui détonne à l'approche d'une flamme.
- Quel est le nom et la formule du gaz qui se dégage ?
On ajoute à la solution obtenue des gouttes de soude et on remarque la formation d’un précipité blanc.
- Donner le nom du précipité blanc.
- Déduire le nom et la formule de l’ion détecté.
- Écrire l'équation bilan de la réaction du zinc avec la solution d'acide chlorhydrique.
V- Exercices
5-4/ Exercice 4
Nous introduisons deux plaques A et B dans deux béchers contenant une solution d'acide chlorhydrique.
On observe l’émission d’un gaz dans le bécher ou se trouve la plaque A, par contre il ne se produit rien dans l’autre bécher.
- Donner le nom du gaz produit
On ajoute des gouttes de solution de soude dans le bécher ou il y a la plaque A et on remarque la formation d'un précipité gélatineux blanc.
- Donner le nom du précipité formé
- Déduire le métal formant la plaque A
La plaque B est caractérisée par une couleur rouge brique.
- Quelle est le métal qui constitue la plaque B ?


