
Physique et Chimie : 3ème Année Collège
Séance 5 (Les solutions acides et les solutions basiques)
Professeur : Mr El GOUFIFA Jihad
Sommaire
I- Solution aqueuse
1-1/ Définition
1-2/ Exemples
II- Mesure du pH d’une solution aqueuse
2-1/ Notion de pH
2-2/ Mesure du pH à l’aide d’un papier indicateur de pH
2-3/ Mesure du pH à l’aide d’un pH-mètre
III- Les solutions acides et les solutions basiques
3-1/ Expérience
3-2/ Observation et interprétation
3-3/ Conclusion
IV- Lien entre le pH et les ion et les ion
V- Dilution d’une solution aqueuse
5-1/ Expérience
5-2/ Observation
5-3/ Conclusion
VI- Les dangers des solutions acides et basiques
6-1/ Les dangers
6-2/ Les précautions
VII- Exercices
7-1/ Exercice 1
7-2/ Exercice 2
7-3/ Exercice 3
7-4/ Exercice 4
I- Solution aqueuse
1-1/ Définition
Une solution est un mélange homogène obtenu par dissolution de soluté dans un solvant.
Le soluté est le corps qui est dissout.
Le solvant est le corps dans lequel s’effectue la dissolution.
Une solution aqueuse est obtenue en dissolvant une substance solide ou liquide ou gazeuse dans l’eau.
C'est une solution électriquement neutre qui si elle contient des cations, alors elle contient nécessairement aussi des anions.
Par exemple L’eau salée est une solution de chlorure de sodium qui contient des ions de chlorure et des ions sodium et le solvant et l’eau.
La distinction entre les types des solutions aqueuse est liée à la prépondérance des ions et , ce caractère se détermine par la mesure du pH de la solution (potentiel d’hydrogène).
1-2/ Exemples
|
Nom de la solution |
Formule chimique |
| Solution de chlorure d'hydrogène (Acide chloridrique) | |
| Solution d’hydroxyde de sodium (Soude) | |
| Solution de sulfate de fer III | |
| Chlorure de sodium (Eau salée) |
II- Mesure du pH d’une solution aqueuse
2-1/ Notion de pH
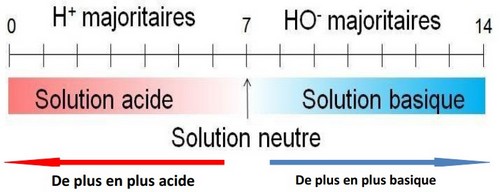
Le pH (potentiel hydrogène) est un nombre sans unité compris entre 0 et 14, il permet d’évaluer l’acidité ou la basicité d’une solution aqueuse.
II- Mesure du pH d’une solution aqueuse
2-2/ Mesure du pH à l’aide d’un papier indicateur de pH
Le papier-pH. C'est un papier imbibé de substances appelées indicateurs colorés.
À chaque couleur que peut prendre le papier correspond une valeur de pH.
On dépose une goûte de solution sur un morceau de papier pH, et on compare sa couleur avec le nuancier de la boite et note le pH correspondant.
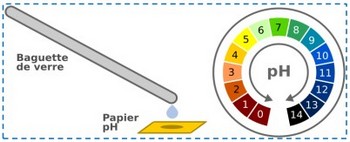
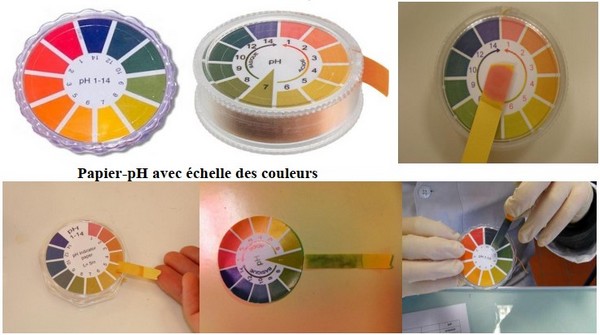
II- Mesure du pH d’une solution aqueuse
2-3/ Mesure du pH à l’aide d’un pH-mètre
Le pH-mètre est un appareil de mesure constitué d’une électrode reliée à un boîtier électronique indiquant la valeur du pH sur un écran.
Pou mesurer le pH d’une solution aqueuse avec le pH-mètre on rince l’électrode et on la plonge dans la solution. La valeur du pH s’affiche sur l’écran du boîtier.
 |
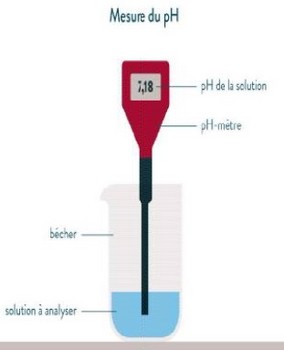 |

III- Les solutions acides et les solutions basiques
3-1/ Expérience
À l’aide d’un pH-mètre on mesure le pH des solutions différentes.
On note les mesures dans un tableau :
| Solution aqueuse | Eaux de chaux | Eau de javel | Solution de soude | Chlorure de sodium | Eau pur | Jus d’orange | Jus de citron | Acide chlorhydrique |
| pH | 9 | 10,4 | 12,5 | 7 | 7 | 4,5 | 3,2 | 1,2 |
3-2/ Observation et interprétation
Le pH des solutions d’eau de chaux, d’eau de javel et la soude est supérieur à 7. On les appelle des solutions basiques.
Le pH des solutions de chlorure de sodium et d’eau pure est égal à 7. On les appelle des solutions neutres.
Le pH des solutions jus d’orange, jus de citron et d’acide chlorhydrique est inférieur à 7. On les appelle des solutions acides.
III- Les solutions acides et les solutions basiques
3-3/ Conclusion
Selon le pH on classe les solutions aqueuses en trois types :
- Des solutions acides ayant un .
- Des solutions basiques ayant un .
- Des solutions neutres ayant un .

Remarque
Une solution est plus acide si son pH est plus petit.
Une solution est plus basique si son pH est plus grand.
IV- Lien entre le pH et les ion et les ion
Toute solution aqueuse contient des molécules d’eau, des ions hydrogène et des ions hydroxyde .
- Une solution acide (pH<7) contient plus d’ions hydrogène que d’ions hydroxyde .
- Une solution basique (pH>7) contient mois d’ions hydrogène que d’ions hydroxyde .
- Une solution neutre (pH=7) contient autant d’ions hydrogène que d’ions hydroxyde .
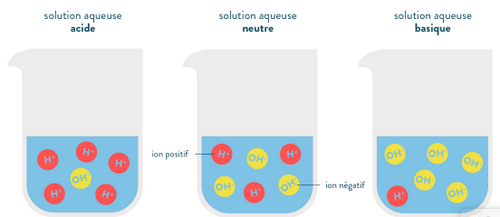
V- Dilution d’une solution aqueuse
5-1/ Expérience
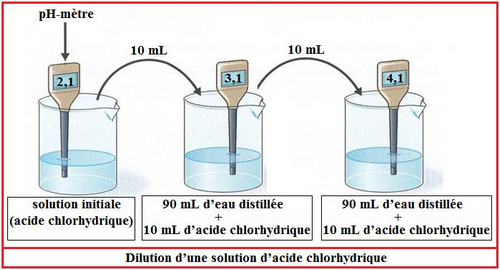
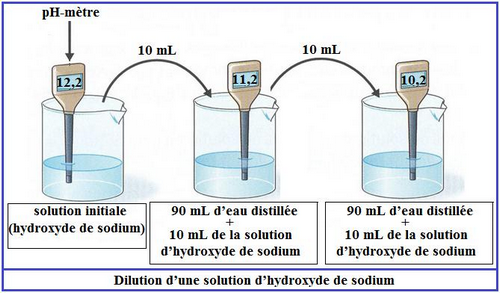
5-2/ Observation
Quant on dilue une solution acide son pH augmente et se rapproche de 7 : elle devient moins acide.
Lorsqu'on dilue une solution basique son pH diminue et se rapproche de 7 : elle devient moins basique.
5-3/ Conclusion
La dilution d’une solution est un procédé consiste à obtenir une solution moins acide ou moins basique à celle de départ.
Lorsqu’on dilue une solution acide ou basique la valeur du pH rapproche à 7.
C’est pourquoi :
- Le pH d’une solution acide augmente.
- Le pH d’une solution basique diminue.
VI- Les dangers des solutions acides et basiques
6-1/ Les dangers
La plupart de ces solutions sont dangereuses, surtout si elles sont concentrées.
Les solutions acides sont corrosifs ce qui peut causer des brûlures graves de la peau et des yeux.
L'inhalation de vapeurs acides peut causer une irritation et des brûlures au système respiratoire.
L'exposition à des acides et des bases faibles ou dilués peut endommager les tissus.
Pour bien connaître les dangers, on rencontre souvent des pictogrammes sur les étiquettes des flacons contenant ces solutions :

VI- Les dangers des solutions acides et basiques
6-2/ Les précautions
Lors de l'utilisation de solutions acides et basiques, les précautions suivantes doivent être prises :
- Ne pas toucher, goûter ou inhaler les solutions.
- Ne mélangez pas les solutions concentrées avec des solutions inconnues.
- Ventilez le lieu d'utilisation de ces solutions.
- Ajoutez de l'acide à l'eau pour éviter la volatilisation des gouttes d'acide.
- Ne jetez pas de solutions acides et alcalines dans les cours d’eau pour préserver l’environnement.
- Diluez les solutions concentrées d'acide et de base avant utilisation.
- Mettez des gants, des lunettes de protection, une blouse ou des vêtements longs.
VII- Exercices
7-1/ Exercice 1
Choisir la bonne réponse :
Le pH d'une solution renseigne sur :
- la quantité d'eau qu'elle contient
- sa température
- son acidité
Une solution est acide lorsque son pH est :
- égal à 7
- inférieur à 7
- supérieur à 7
Une solution est neutre lorsque son pH est :
- égal à 0
- égal à 7
- égal à 14
Pour mesurer le pH d'une solution, on peut utiliser :
- un thermomètre
- une balance
- un papier indicateur
Les solutions acides et basiques concentrées sont dangereuses car elles sont :
- corrosives
- explosives
- inflammables
VII- Exercices
7-2/ Exercice 2
Recopier et compléter les phrases en utilisant les mots suivants:
nuancier - basique - papier indicateur de pH - acide - pH-mètre - unité dangereuses - pH - précautions - neutre.
Le ________________ d'une solution est un nombre sans ________________ qui permet de savoir si cette solution est acide, basique ou ________________
Une solution est ________________ si son pH est supérieur à 7 alors qu'une solution ________________ a un pH inférieur a 7.
Pour mesurer le pH, on peut utiliser un ________________ et comparer la couleur prise avec le ________________
Un ________________ affiche une valeur plus précise.
Une solution acide concentrée et une solution basique concentrée sont aussi ________________ l'une que l'autre; elles doivent être manipulées avec ________________ .
VII- Exercices
7-3/ Exercice 3
Sarah a mesuré le pH de quelques solutions courantes, elle a rassemblé ses résultats dans un tableau :
| Solution | ---A--- | ---B--- | ---C--- | ---D--- | ---E--- | ---F--- |
| pH | 8 | 2 | 9 | 7 | 3 | 6 |
| Nature de la solution |
- Ces mesures ont-elles effectuées avec du papier pH ou bien un pH-mètre ? Justifiez.
- Compléter la dernière ligne de ce tableau en écrivant la nature acide, basique ou neutre de la solution. Justifiez.
- Classez les solutions acides de ce tableau par acidité croissante. Justifiez
VII- Exercices
7-4/ Exercice 4
Une solution dont le pH =12 contient ions par litre.
Sachant que la valeur du pH diminue d’une unité quand le nombre d’ion est multiplié par 10 :
1) Trouver la valeur du pH d’une solution contenant ions par litre.
2) Trouver la valeur du pH d’une solution contenant ions par litre.
3) Quelle sera le nombre d’ion dans un litre de solution de ?


