
Physique et Chimie : 2ème Année Bac
Séance 9 (État d'équilibre d'un système chimique)
Professeur : Mr El GOUFIFA Jihad
Sommaire
I- Quotient de réaction
1-1/ Définition
1-2/ propriété
1-3/ Exemples
II- Quotient de réaction à l’état d’équilibre
2-1/ Définition
2-2/ Détermination du quotient de la réaction à l'équilibre par conductimétrie
III- Constante d’équilibre associée à une transformation chimique
IV- Influence de l'état initial et de la constante d’équilibre sur le taux d'avancement à l'équilibre
4-1/ Influence de l'état initial
4-2/ Influence de la constante d’équilibre
V- Exercice
5-1/ Exercice 1
5-2/ Exercice 2
5-3/ Exercice 3
5-4/ Exercice 4
I- Quotient de réaction
1-1/ Définition
Le quotient de la réaction est une grandeur qui caractérise un système chimique dans un état donné, sa valeur nous renseigne sur l'évolution du système étudié.
Par convention dans l'expression de , il ne figure que les concentrations molaires des espèces dissoutes (le solvant "eau" ou les solides n'interviennent pas).
1-2/ propriété
Le quotient de la réaction est associé à l'équation d'une réaction écrite dans un sens donné.
Si on écrit l'équation dans l'autre sens, son quotient de réaction est l'inverse du précédent :
I- Quotient de réaction
1-3/ Exemples
Réaction dans laquelle tous les réactifs et les produits sont à l'état aqueux
Réaction dans laquelle le solvant "eau" intervient comme réactif
Réaction dans laquelle interviennent les solides

II- Quotient de réaction à l’état d’équilibre
2-1/ Définition
Le quotient de réaction à l'état d'équilibre (noté ) est la valeur que prend le quotient de réaction lorsque l'état
d'équilibre du système chimique est atteint.
A l'état d'équilibre, les concentrations des espèces en solution ne varient plus, elles peuvent être déterminées par des méthodes chimiques ou physiques comme le dosages, la pH-métrie ou la conductimétrie.
2-2/ Détermination du quotient de la réaction à l'équilibre par conductimétrie
Méthode utilisée
La cellule conductimétrique permet de mesurer la conductance exprimée en siemens (S) d'une solution électrolytique .
Ensuite nous savons que la conductance d'une partie de la solution de surface S et de longueur L est donnée par la relation
représente la conductivité de la solution ,donc la cellule permet de déterminer la conductivité de la solution.
D'autre part dans une solution électrolytique qui résulte de la dissolution d'un composé ionique MX dans l'eau, la conductivité est liée aux concentrations molaires des espèces ioniques par la relation suivante :
: représente la conductivité molaire ionique en
Ce qui permet donc de connaître les concentrations des espèces ioniques en solution, et de déterminer le quotient de la réaction.
II- Quotient de réaction à l’état d’équilibre
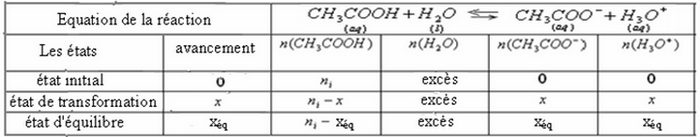
Exemple (Réaction de l'acide éthanoïque avec l'eau)
En mesurant la conductivité d'une solution d'acide éthanoïque de concentration , on trouve
1) Déterminer les concentrations molaire des espèces chimiques dissoutes dans la solution à l'équilibre.
2) Déterminer la valeur du quotient de la réaction à l'équilibre
On donne :
Tableau d’avancement:
III- Constante d’équilibre associée à une transformation chimique
Les études expérimentales ont montrées que le quotient de la réaction à l'équilibre à la même température reste constant quel soit l'état initial du système .
La constante d'équilibre associée à l'équation d'une réaction est la valeur que prend le quotient de réaction à l'état d'équilibre du système.
est une grandeur sans unité qui ne dépend que de la température
Remarque 1
La constante d'équilibre est associée à l'équation d'une réaction écrite dans un sens donné.
Si l'on écrit l'équation dans l'autre sens, sa constante d'équilibre sera l'inverse de la précédente :
Remarque 2
La transformation limitée conduit à un état d’équilibre donc l'état final correspond à l’état d'équilibre :
IV- Influence de l'état initial et de la constante d’équilibre sur le taux d'avancement à l'équilibre
4-1/ Influence de l'état initial
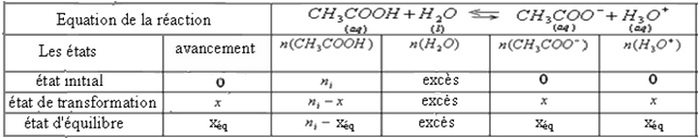
Le taux d'avancement de la réaction dépend de l'état initial du système.
Plus la solution d'acide est diluée, plus le taux d'avancement à l'équilibre est grand.
IV- Influence de l'état initial et de la constante d’équilibre sur le taux d'avancement à l'équilibre
4-2/ Influence de la constante d’équilibre
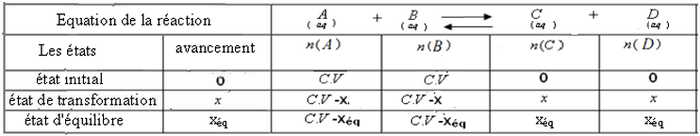
Cette expression montre que le taux d'avancement de la réaction dépend de la constante d'équilibre K.
Plus que la constante d'équilibre K est grande plus que le taux d'avncement de la réaction est élevé.
Si , la réaction est considérée comme totale.
V- Exercice
5-1/ Exercice 1
On dissout un comprimé d'aspirine (notée AH dans la suite) de masse dans un volume d'eau distillée.
La mesure du pH de la solution obtenue donne .
- Ecrire l'équation de la réaction acido-basique entre l'aspirine et l'eau.
- Déterminer la concentration finale des ions oxonium dans la solution.
- Déterminer la quantité de matière d'aspirine initiale contenue dans un comprimé, sachant que .
- Dresser le tableau d'avancement de la réaction de l'aspirine avec l'eau.
- Déterminer l'avancement final de la transformation.
- Déterminer la concentration molaire de l'aspirine à l'équilibre.
V- Exercice
5-2/ Exercice 2
Le pH de la solution d’acide méthanoïque de concentration est
- Écrire l'équation de la réaction chimique d’acide méthanoïque avec l’eau.
- Dresser le tableau d'avancement de la réaction chimique.
- Montrer que la réaction chimique n’est pas totale.
- Calculer les concentrations molaires finales des ions de la solution à l’état final de la réaction chimique. (on néglige les ions )
V- Exercice
5-3/ Exercice 3
On considère une solution d’acide benzoïque de concentration et de conductance G=2.03 x 10-4S.
Les dimensions de la cellule conductimétrique sont et
- Écrire l’équation de la réaction chimique.
- Dresser le tableau d’avancement de la réaction chimique.
- Calculer les concentrations des ions de la réaction chimique.
- Calculer le taux d'avancement final de la réaction.
- Calculer la constante d’équilibre de la réaction chimique.
et
V- Exercice
5-4/ Exercice 4
On prépare d'une solution aqueuse obtenue en dissolvant dans l'eau de méthylamine et de chlorure d'ammonium
1- Équation de réaction
- 1- Rappeler la définition d'un acide, d'une base, d'un couple acide-base.
- 2- Écrire l'équation de la réaction entre les molécules basiques de méthylamine et les ions ammonium acides . Préciser les deux couples acide-base qui interviennent.
2- Tableau d'avancement de la réaction
- 1- Calculer, en mole, les quantités initiales de réactifs.
- 2- Construire le tableau d'avancement de la réaction.
3- Avancement de la réaction à l'équilibre
- Calculer l'avancement final de la réaction à l'équilibre sachant que la conductivité de la solution vaut alors (voir les conductivités molaires ioniques dans le tableau ci-dessous)
4- Concentrations molaires volumiques des espèces chimiques en solution à l'équilibre
- Calculer, en mole /L, les concentrations molaires volumiques des espèces chimiques en solution à l'équilibre.
5- Constante d'équilibre K associée à l'équation de la réaction étudiée
- Définir et calculer la constante d'équilibre K associée à l'équation de la réaction étudiée.
Masses molaires atomiques :
|
7,63 |
7,34 |
5,87 |


