
Physique et Chimie : 2ème Année Bac
Séance 4 (Transformations lentes et transformations rapides)
Professeur : Mr El GOUFIFA Jihad
Sommaire
I- Réactions d'oxydoréduction
1-1/ Expérience
1-2/ Interprétation
1-3/ Généralisation
1-4/ Exemples
1-5/ Conclusion
II- Transformations lentes et transformations rapides
2-1/ Transformations rapides
2-2/ Transformations lentes
III- Les facteurs cinétiques
3-1/ Définition
3-2/ Influence de la températures sur la vitesse de la réaction
3-3/ Influence de la concentration initiale des réactifs
IV- Application des facteurs cinétiques
4-1/ Accélération ou déclenchement d’une transformation chimique.
4-2/ Ralentissement ou blocage d’une transformation chimique.
V- Exercices
5-1/ Exercice 1
5-2/ Exercice 2
5-3/ Exercice 3
5-4/ Exercice 4
I- Réactions d'oxydoréduction
1-1/ Expérience
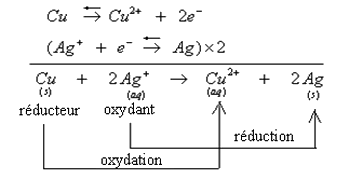
On immerge partiellement une plaque de cuivre dans une solution de nitrate d'argent
On constate la formation d'un dépôt d'agent sur la partie immergée de la plaque et on constate que la solution prend une coloration bleue caractéristique des ions .
1-2/ Interprétation
Au cours de cette transformation chimique le cuivre s'est oxydé en Cu2+ selon la demi-équation suivante :
Les ions Ag+ sont réduits en argent métallique selon la demi-équation suivante :
Les deux couples d'oxydo-réduction participants à cette transformation sont : et .
L'équation bilan d'oxydo-réduction est obtenue en ajoutant membre à membre les deux demi-équations précédentes :
I- Réactions d'oxydoréduction
1-3/ Généralisation
Chaque couple Ox/Red est caractérisé par sa demi-équation d'oxydoréduction:
Une réaction d'oxydoréduction est caractérisée par un transfert d'électrons entre l'oxydant d'un couple et le réducteur d'un autre couple .
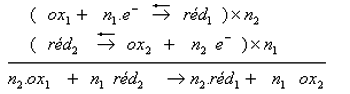
I- Réactions d'oxydoréduction
1-4/ Exemples
- Écrire les demi-équations d'oxydo-réduction pour chacun des couples suivants:
- Écrire l'équation d'oxydo-réduction entre les ions ferreux et les ions permanganates en milieu acide sachant que les deux couples d'oxydo-réduction participants à cette transformation sont et
I- Réactions d'oxydoréduction
1-5/ Conclusion
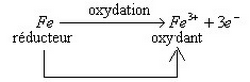
Un oxydant est une espèce chimique capable de capter un ou plusieurs électrons au cours d'une transformation chimique.
Un réducteur est une espèce chimique capable de céder un ou plusieurs électrons au cours d'une transformation chimique.
- L'oxydation est une perte d'un ou plusieurs électrons.
- La réduction est un gain d'un ou plusieurs électrons.
 |
 |
II- Transformations lentes et transformations rapides
2-1/ Transformations rapides
Définition
Une transformation rapide est une transformation qui se fait en une courte durée de telle façon qu'on ne peut pas suivre son évolution en fonction du temps avec l'œil ou avec les appareils de mesure.
Exemples
- Précipitation du chlorure d'argent

- Précipitation de l'hydroxyde de fer III

II- Transformations lentes et transformations rapides
2-2/ Transformations lentes
Définition
Une transformation lente est une transformation qui se fait dans une certaine durée de telle façon qu'on suivre son évolution en fonction du temps avec l'œil ou avec les appareils de mesure.
Exemples
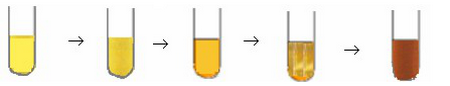
- Réaction entre les ions iodures et l'eau oxygénée (peroxyde d'hydrogéne)
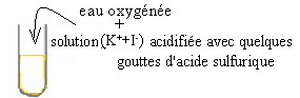
Il y'a formation progressive du diiode caractérisé par sa coloration brune
On constate que la couleur du mélange réactionnel évolue progressivement du jaune au jaune foncé puis prend une coloration brune qui devient de plus en plus foncée en fonction du temps.
L'équation bilan d'oxydo-réduction :
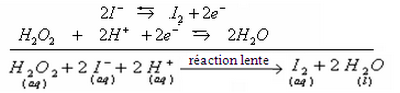
III- Les facteurs cinétiques
3-1/ Définition
On appelle facteur cinétique tout paramètre capable d'influer sur la vitesse d'une transformation chimique.
3-2/ Influence de la températures sur la vitesse de la réaction
Expérience
Pour mettre en évidence l'influence de la température sur la vitesse de la réaction on réalise l'expérience suivante:

Observation
L'apparition de la couleur brune est plus rapide dans le mélange A+C que dans le mélange B+D
Conclusion
D'une manière générale, plus la température du milieu réactionnel est élevée, plus la transformation est rapide et vice versa.
On dit que la température est un facteur cinétique.
III- Les facteurs cinétiques
3-3/ Influence de la concentration initiale des réactifs
Expérience

Observation
L'apparition de la couleur brune est plus rapide dans le mélange A+C que dans le mélange B+D
Conclusion
La formation du diiode augmente avec la concentration initiale des réactifs.
De façon générale l’avancement d’une réaction augmente avec la concentration initiale des réactifs.
On dit que la concentration des réactifs est un facteur cinétique.
Comme applications au laboratoire la dilution : en diminuant la concentration des réactifs on peut ralentir ou stopper une réaction.
IV- Application des facteurs cinétiques
4-1/ Accélération ou déclenchement d’une transformation chimique.
De nombreuses synthèses industrielles sont des transformations lentes à température ordinaire; les contraintes économiques obligent à les réaliser à températures élevées.
Exemples
Synthèse de l’ammoniac, du trioxyde de soufre, Synthèse organiques...
Pour accélérer la cuisson des aliments, on utilise un autocuiseur où la température est voisine de 110°C
4-2/ Ralentissement ou blocage d’une transformation chimique.
Exemple 1
Les aliments subissent, sous l’action de micro-organismes, des réactions de dégradation altérant leur goût et pouvant conduire à des toxines graves pour la santé.
Ils sont donc conservés au réfrigérateur (4°C environ) et au congélateur (18°C environ).
Exemple 2
Les cellules et les tissus biologiques (spermatozoïdes, ovules, embryons) sont maintenues dans l’azote liquide à -195°C pour stopper les réactions biologiques et la division cellulaire.
V- Exercices
5-1/ Exercice 1
Le fer est attaqué par les acides.
Lorsque l’on place un clou en fer de 1,5 g dans 50 mL d’une solution acide (ions à ), on observe un dégagement gazeux de dihydrogène et la formation d’ions fer II .
- Écrire l’équation bilan de la réaction et indiquer les couples mise en jeu.
- Faire le bilan des espèces présentes à l'état initial.
- Le clou a-t-il été entièrement détruit ?
- Indiquer avec précision les quantités de matières présentes dans la solution lorsque la réaction est terminée.
- Quel est le volume de dihydrogène dégagé par cette réaction ?
- Quelle est la concentration en ions fer II et en ions lorsque la réaction est terminée ?
On prendra un volume molaire pour les gaz de .
V- Exercices
5-2/ Exercice 2
Nous mélangeons à 25°C, un volume de l’eau oxygénée acidifié de concentration molaire et un volume d’iodure de potassium de concentration molaire .
- Déterminer les deux couples qui interviennent dans la réaction et écrire la demi-équation de chaque couple.
- Déduire l’équation bilan.de la réaction d’oxydoréduction.
- Quelle est l’évolution du mélange qui se produit que nous pouvons distingué à l’œil nu.
- Dresser le tableau d’évolution de la réaction.
- Calculer l’avancement maximal , et déduire le réactif limitant.
- Déduire la quantité de matière de la diode formée à la fin de l’expérience.
- Nous répétons l’expérience précèdent toute en gardant la même température et en augmentant la concentration de la solution iodure de potassium à . Qu’arrivera-t-il à la durée de la réaction ?
- Que se passerait-il-si nous mettons le premier mélange dans l’eau glacée ?
V- Exercices
5-3/ Exercice 3
On plonge une lame de zinc de masse dans Line solution d ’acide chlorhydrique en excès.
Au cours de la réaction il y a formation des ions et production d’un gaz qui donne une détonation en présence d ’une flamme.
- Écrire les demi-équations redox et l’équation bilan entre l'acide chlorhydrique et le zinc.
- Dresser le tableau d'avancement de la réaction, et déterminer l'avancement maximal.
- Calculer le volume de dihydrogène libéré à la fin de réaction.
- Calculer la masse du chlorure de zinc formé à la fin de la réaction.
On donne :
V- Exercices
5-4/ Exercice 4
Pour une solution de diiode , on verse un volume dans un bécher avec l’empois d'amidon ; on obtient alors une solution bleu foncé (l'empois d'amidon est un indicateur coloré permettant de visualiser le passage de l'équivalence : avant l'équivalence la solution est bleue et après l'équivalence la solution est incolore).
Dans une burette graduée, on introduit une solution de thiosulfate de sodium où la concentration des ions thiosulfate est .
On fait couler cette solution dans le bécher jusqu’à disparition de la couleur bleu foncé : on verse un volume de solution titrante.
La disparition de la couleur bleue foncé démontre la disparition totale du diiode dans le bécher.
- Écrire l'équation de la réaction du dosage sachant que les couples d'oxydo-réduction mis en œuvre sont et .
- Préciser lors de cette équation chimique quelle est l’espèce oxydante et l’espèce réductrice.
- Définir l'équivalence d’un dosage.
- À l'aide d'un tableau d'avancement déterminer la relation que l'on peut écrire à l'équivalence.
- Calculer la concentration de diiode dans la solution dosée.
- En déduire la masse de diiode dans le volume de solution.
- À l'équivalence, déterminer la concentration de toutes les espèces chimiques présentes dans le mélange.
Données : masse molaire de diiode : .



