
Physique et Chimie : 1ère Année Collège
Séance 10 (La dissolution dans l'eau)
Professeur : Mr El GOUFIFA Jihad
Sommaire
I- La solution
1-1/ Définition
1-2/ Le soluté
1-3/ Le solvant
II- Dissolution d'un solide
2-1/ Expérience 1
2-2/ Observation 1
2-3/ Conclusion 1
2-4/ Expérience 2
2-5/ Observation 2
2-6/ Conclusion 2
III- Saturation d'une solution aqueuse
3-1/ Expérience
3-2/ Observation
3-3/ Interprétation
3-4/ Conclusion
3-5/ Remarques
IV- Conservation de la masse lors d'une dissolution
4-1/ Expérience
4-2/ Observation
4-3/ Conclusion
V- Exercices
5-1/ Exercice 1
5-2/ Exercice 2
5-3/ Exercice 3
5-4/ Exercice 4
I- La solution
1-1/ Définition
Une solution est un mélange homogène obtenu par dissolution d’une espèce chimique (le soluté) dans un liquide (le solvant).
1-2/ Le soluté
C'est une espèce chimique destinée à se dissoudre dans un solvant.
Il peut se présenter à l’état solide, liquide ou gazeux.
1-3/ Le solvant
Il s’agit du liquide dans lequel est dissous le soluté.
Si le solvant est l’eau la solution est appelée solution aqueuse.
II- Dissolution d'un solide
2-1/ Expérience 1
Dans cinq béchers différents contenant de l'eau, on ajoute : du sel, du sucre, du sulfate de cuivre anhydre, du sable et de la terre puis on agite.

2-2/ Observation 1
Bécher 1: les cristaux de sel ne sont plus visibles: le sel se dissout dans l'eau.
Bécher 2: les cristaux de sucre ne sont plus visibles: le sucre se dissout dans l'eau.
Bécher 3: le sulfate de cuivre anhydre colore le mélange en bleu mais ses cristaux ont disparu: le sulfate de cuivre anhydre se dissout dans l'eau.
Bécher 4: les grains de sable se diposent rapidement au fond du récipient: le sable ne se dissout pas.
Bécher 5: les particules de terre se dispersent dans l'eau mais restent visibles: la terre ne se dissout pas.
2-3/ Conclusion 1
La dissolution d'un solide dans l'eau n'est pas toujours possible. Certains sont dits solubles (ils sont capables de se dissoudre dans l'eau), les autre sont insolubles.
II- Dissolution d'un solide
2-4/ Expérience 2
On porte l’eau salée à ébulition
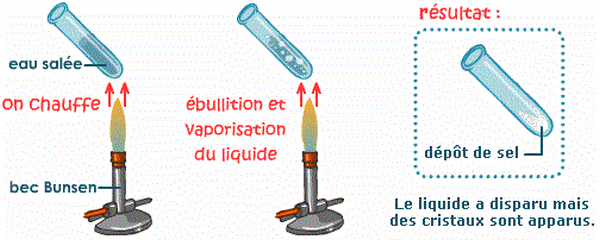
2-5/ Observation 2
L'ébullition provoque donc la vaporisation de l'eau, mais les cristaux de sel se reforment.
2-6/ Conclusion 2
Lors d'une dissolution, le solide ne disparaît pas, il n'est simplement plus visible à l'œil nu : sous l'effet de l'eau, les particules solides se sont divisées en particules nettement plus petites, de taille microscopique, puis se sont dispersées.
III- Saturation d'une solution aqueuse
3-1/ Expérience
On réalise un mélange d'eau et d'une quantité importante de sel.

3-2/ Observation
Après agitation, une partie du sel s'est dissoute, mais l'autre reste sous forme de cristaux.
3-3/ Interprétation
La solubilité du sel dans l'eau possède une limite, l'eau ne peut pas dissoudre n'importe quelle quantité de sel. Lorsque cette limite est atteinte, on dit que la solution est saturée.
3-4/ Conclusion
Tout composé soluble ne peut se dissoudre dans l'eau qu'en quantité limitée. Lorsque cette limite est atteinte, on dit que la solution est saturée.
Si une quantité supplémentaire de soluté est ajoutée à une solution déjà saturée, elle ne peut se dissoudre.
3-5/ Remarques
La limite de saturation dépend du composé à dissoudre (pour le sel elle est atteinte en ajoutant environ 360 g à un litre d'eau et 2 Kg pour le sucre).
La limite de saturation peut être repoussée en chauffant le mélange.
IV- Conservation de la masse lors d'une dissolution
4-1/ Expérience
- Placer sur une balance électronique du sel et un bécher contenant de l'eau.
- Mesurer la masse de l'ensemble.
- Mélanger les deux.
- Mesurer leur masse à nouveau.
4-2/ Observation
La masse totale du sel et de l'eau reste la même avant et après la dissolution.
4-3/ Conclusion
La masse totale du solvant et du soluté reste inchangée au cours de la dissolution.
V- Exercices
5-1/ Exercice 1
On dissout 20 g de sucre dans l’eau, on obtient une solution (S1) de volume 400 mL.
- Définir les mots suivants :
Solvant : ______________________________
Soluté : ______________________________
Solution : ______________________________
- Préciser le solvant et le soluté.
- Quel est le nom de la solution obtenue ?
V- Exercices
5-2/ Exercice 2
On verse 30 ml d’eau dans un bécher de masse , puis on y ajoute de sucre.
Après agitation on obtient une solution homogène.
La solubilité du sucre dans l’eau à est et la masse volumique de l’eau est .
- Préciser le solvant et le soluté.
- Est-ce que le sucre a disparu du bécher ?
- Si on pose le bécher sur une balancer électrique, quelle valeur affichera-telle ?
- Quelle est la masse minimale du sucre qu’il faut ajouter pour obtenir deux phases ?
V- Exercices
5-3/ Exercice 3
On dissout du sel à dans un volume d’eau.
On rappelle que la solubilité du sel à cette température est .
- Justifier pourquoi la solution n’est pas saturée.
On fait bouillir le mélange puis on laisser froidir.
- Quel est le volume minimal de la quantité d’eau vaporisée pour avoir après refroidissement un mélange non homogène.
V- Exercices
5-4/ Exercice 4
On dépose un glaçon dans un verre vide et un sucre dans un verre d’eau.
- Que va-t-il se passe pour le glaçon ?
- Que va-t-il se passe pour le sucre ?
- Dans quel cas assiste-t-on à un changement d’état ?



