
Physique et Chimie : 2ème Année Collège
Séance 6 (Les lois de la réaction chimique)
Professeur : Mr El GOUFIFA Jihad
Sommaire
I- Introduction
II- Loi de conservation de la masse dans une réaction chimique
2-1/ Expérience
2-2/ Observation
2-3/ Conclusion
III- Loi de conservation des atomes dans une réaction chimique
3-1/ Exemple
3-2/ Observation
3-3/ Conclusion
IV- Équations chimiques
4-1/ Écriture de l’équation chimique
4-2/ Comment équilibrer une équation chimique ?
4-3/ Conclusion
V- Exercices
5-1/ Exercice 1
5-2/ Exercice 2
5-3/ Exercice 3
5-4/ Exercice 4
I- Introduction
Dans une transformation chimique les substances mises en jeu (réactifs) en différentes quantités réagissent et se transforment.
- Les molécules et les atomes sont-ils conservés au cours d'une transformation chimique ?
- La masse se conserve-t-elle au cours d'une transformation chimique ?
II- Loi de conservation de la masse dans une réaction chimique
2-1/ Expérience
On pèse 4g de soufre et 7g de poudre de fer.
Après on chauffe le mélange jusqu’à l’incandescence à l’aide du bec Bensun:
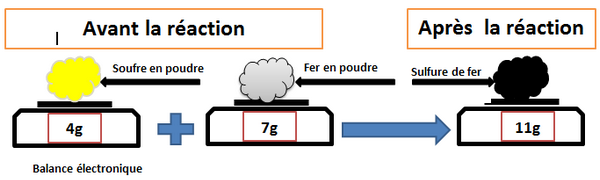
2-2/ Observation
On observe que la masse du produit est égale à la somme des masses des réactifs: .
On dit que la masse a été conservée, c'est-à-dire la masse ne change pas.
2-3/ Conclusion
Loi de Lavoisier: Au cours d'une réaction chimique, la somme des masses des réactifs disparus est égale à la somme des masses des produits formés.
III- Loi de conservation des atomes dans une réaction chimique
3-1/ Exemple
On prend l'exemple de la combustion complète du carbone de bilan chimique suivant :

3-2/ Observation
Au cours de cette réaction chimique :
- Le genre des atomes ne change pas.
- Le nombre d’atomes de chaque genre ne change pas.
3-3/ Conclusion
Au cours d’une réaction chimique, les atomes présents dans les réactifs sont identiques en genre et en nombre aux atomes présents dans les produits : il y a conservation des atomes
| Au cours d’une réaction chimique, rien ne se perd, rien ne se crée, tout se transforme. |
IV- Équations chimiques
4-1/ Écriture de l’équation chimique
Exemple
Le bilan de réaction du carbone avec le dioxygène s’écrit sous la forme suivante :
En utilisant les symboles atomiques et les formules moléculaires, on écrit l’équation chimique:
Conclusion
La réaction chimique est représentée au niveau atomique par une équation chimique.
IV- Équations chimiques
4-2/ Comment équilibrer une équation chimique ?
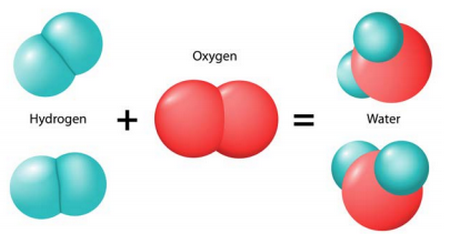
On prend l’exemple de la réaction entre le dihydrogène et le dioxygène:
Le modèle moléculaire
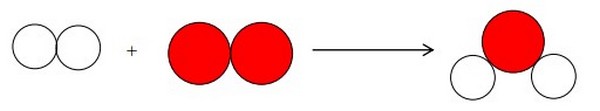
Équation globale de la réaction
Dans cette équation, on observe que le nombre des atomes d’oxygène n'est pas conservé.
On dit que l’équation est non équilibrée.
Nous devons équilibrer cette équation en utilisant des coefficients stœchiométriques écris à gauche des formules chimiques.
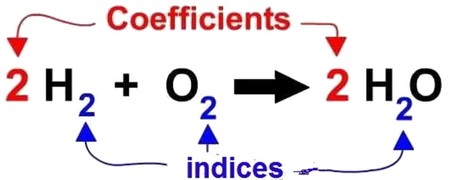
IV- Équations chimiques
4-3/ Conclusion
Pour écrire l'équation bilan d'une réaction chimique, nous utilisons les formules chimiques des réactifs et des produits.
Pour que les atomes conservent en genre et en nombre, l'équation chimique est équilibrée à l'aide de coefficients stœchiométriques.
V- Exercices
5-1/ Exercice 1
- Placer les mots suivants dans la bonne place :
chimique - réactifs - conservation de la masse - physique - produits - réarrangent - réactifs - conservation des atomes - identiques - réactifs
Au cours d’une transformation ______________ , la masse des réactifs est égale à la masse des ______________ . C’est la loi de la __________________ .
Au cours d’une transformation chimique, les atomes des ______________ se ______________ pour former les molécules des ______________ .
Les atomes présents dans les produits sont ______________ en type et en nombre aux atomes présents dans les ______________ . C’est la loi de la ______________ .
V- Exercices
5-2/ Exercice 2
- Équilibrez les équations chimiques suivantes :
V- Exercices
5-3/ Exercice 3
La combustion de de fer dans le dioxygène donne d'oxyde de fer magnétique de formule : .
- Identifier les réactifs et les produits
- Donner l'expression écrite de cette réaction
- Écrire l’équation cette réaction équilibrée
- Calculez la masse de dioxygène qui va réagir
- Calculez le volume du dioxygène réagit, sachant que la masse de de dioxygène est .
- Quel est le volume de dioxygène nécessaire pour brûler de fer ?
- Quel est le volume de l'air est nécessaire pour cette combustion ?
V- Exercices
5-4/ Exercice 4
La combustion de d'éthane dans une masse de dioxygène conduit à la formation de de dioxyde de carbone et de l’eau .
- Donner les réactifs et les produits.
- Écrire le bilan chimique de cette transformation chimique.
- Donner l’équation chimique de cette réaction.
- Donner la définition de la loi de conservation des masses.
- Calculer la masse de dioxygène.
- Sachant que la combustion de d'éthane nécessite de dioxygène, calculer la masse d'éthane qui brûle de dioxygène.


