
Physique et Chimie : 2ème Année Bac
Séance 28 (Réactions d'estérification et d'hydrolyse)
Professeur : Mr El GOUFIFA Jihad
Sommaire
I- Rappel
1-1/ La chimie organique
1-2/ Les alcanes et les radicaux alkyles
1-3/ Nomenclature des alcanes ramifiés
II- Les composés organiques oxygénés
2-1/ Les alcools
2-2/ Les acides carboxyliques
2-3/ Anhydride de l'acide carboxylique
III- Les réactions d’estérification et hydrolyse d’un ester
3-1/ Les esters
3-2/ La réaction d'estérification
3-3/ La réaction d'hydrolyse
3-4/ L’expérience de Berthelot
IV- Équilibre chimique : estérification hydrolyse
4-1/ Notion d'équilibre : estérification hydrolyse
4-2/ Les facteurs influençant l'équilibre
V- Exercices
5-1/ Exercice 1
5-2/ Exercice 2
5-3/ Exercice 3
5-4/ Exercice 4
I- Rappel
1-1/ La chimie organique
La chimie organique est la chimie des composés carboniques, c’est-à-dire les molécules contenant les élément C et H.
La configuration électronique du carbone est .
Afin de vérifier la condition d’octet, l’atome de carbone a quatre électrons dans la couche externe, donc quatre électrons de valence, on dit qu'il est tétravalent.
Représentation de Lewis :
| Pour le carbone |  |
| Pour l’oxygène |  |
| Pour l’azote | 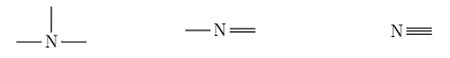 |
On peut représenter la molécule organique en utilisant plusieurs façons :
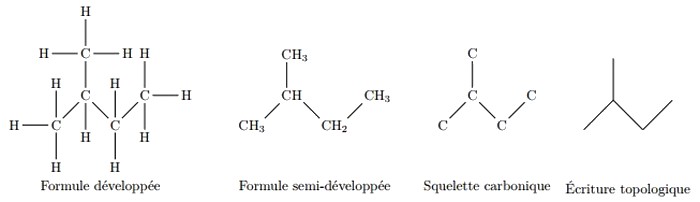
I- Rappel
1-2/ Les alcanes et les radicaux alkyles
Les alcanes
Les alcanes sont des hydrocarbures saturés de formule brute générale , où .
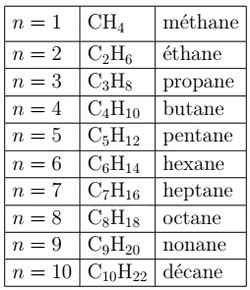
I- Rappel
1-2/ Les alcanes et les radicaux alkyles
Les radicaux alkyles
Les radicaux alkyles ont pour formule brute .
Le radical alkyl dérive d'un alcane par perte d'un atome d'hydrogène.
Le nom du radical alkyl s'obtient à partir du nom de l'alcane correspondant en remplaçant la terminaison "ane" par "yle" :
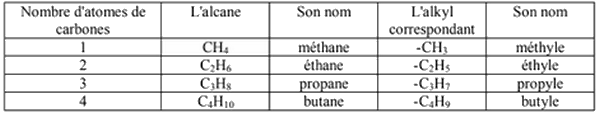
I- Rappel
1-3/ Nomenclature des alcanes ramifiés
La chaîne carbonée la plus longue est appelée chaîne principale, elle donnera son nom à l’alcane. Par exemple :
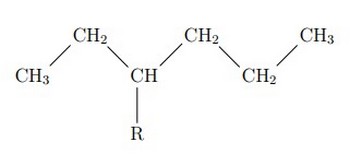
Si on parle d’méthyl, si on parle d’éthyl.
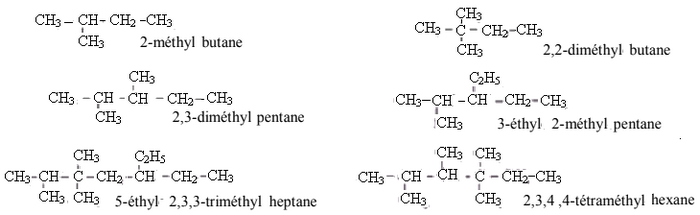
Pour cette molécule on a 6 carbones, donc il s’agit du préfixe hex, R se trouve dans l’emplacement 3, alors le nom de cette espèce est : 3-méthyl-hexane.
II- Les composés organiques oxygénés
2-1/ Les alcools
Les alcools sont caractérisés par le groupe OH d’hydroxyde. Leur formules brute est .
Selon que l'atome de carbone portant le groupe caractéristique -OH est lié à 1, 2 ou 3 atomes de carbone, l'alcool est qualifié de primaire, secondaire, tertiaire :

La nomenclature des alcools est très semblable à la nomenclature des alcane et s'appuie sur la même méthode.
Le suffixe -ane est remplacée par le suffixe -ol, précédé de sa position sur la chaîne carbonée. Celle-ci doit être numérotée de façon à ce que cet indice soit le plus faible possible.
Exemples :
- méthane méthanol
- éthane éthanol
- propane propanol
- butane butanol
Pour les alcools ramifiés, la chaîne carbonée principale est la plus longue chaîne qui comporte le carbone fonctionnel, et pour préciser la position du groupe -OH sur la chaîne carbonée on utilise le suffixe (ol) précédé du plus petit nombre qui indique la position du carbone fonctionnel sur la chaîne carbonée principale.
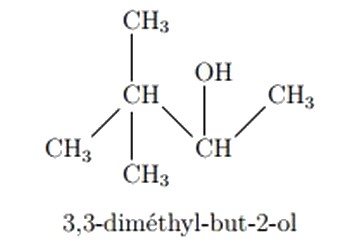
II- Les composés organiques oxygénés
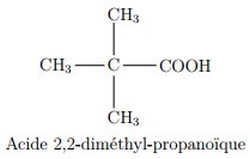
2-2/ Les acides carboxyliques
Les acides carboxyliques sont des molécules comprenant un groupement carboxyle (–C(O)OH) :

Les acides carboxyliques sont liquides dans les conditions normales tant que leur chaîne carbonée présente moins de 8 atomes de carbone. Ils sont solides au-delà.
Le nom d’un acide carboxylique dérive de celui de l’alcane de même squelette carboné en remplaçant le - e final par la terminaison -oïque, l’ensemble étant précédé du mot acide :
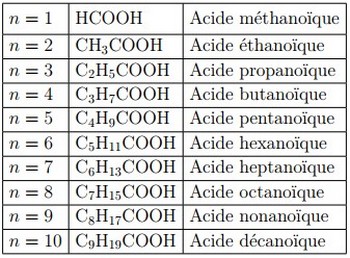
Pour les acides ramifiés, on commence la numérotation à partir le carbone fonctionnel du groupe COOH.
II- Les composés organiques oxygénés
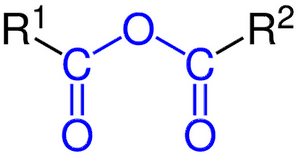
2-3/ Anhydride de l'acide carboxylique
Un anhydride d'acide carboxylique est un composé organique qui résulte de la déshydratation (perte d'une molécule H2O) d'un acide carboxylique.
Leur formule générale est :
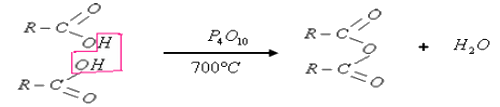
La préparation de l'anhydride de l'acide carboxylique se fait à partir de l'acide carboxylique par chauffage à 700°C et en utilisant un déshydratant (comme l'oxyde de phosphore ).
Pendant cette réaction, il y'a élimination d'une molécule d'eau entre deux molécules d'acide :
III- Les réactions d’estérification et hydrolyse d’un ester
3-1/ Les esters
Les esters sont des composés odorants, que l’on trouve en abondance dans les fruits mûrs, ainsi ils entrent dans la composition, des huiles, des parfums.
Les esters possèdent un groupe caractéristique appelé ester : , noté aussi .
Leur formule générale est :

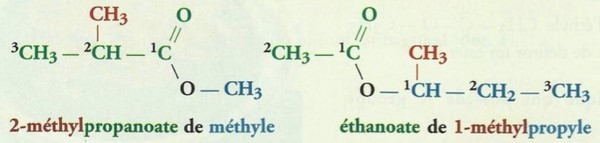
Le nom d’un ester comporte deux termes :
- Le premier, qui se termine en -oate, désigne la chaîne dite principale provenant de l’acide carboxylique ; cette chaîne est, si nécessaire, numérotée à partir de l’atome de carbone fonctionnel.
- Le second, qui se termine en -yle, est le nom du groupe alkyle provenant de l’alcool ; cette chaîne est, si nécessaire, numérotée à partir de l’atome de carbone lié à l’atome d’oxygène.
Exemples :
III- Les réactions d’estérification et hydrolyse d’un ester
3-2/ La réaction d'estérification
L'estérification est une réaction au cours de laquelle un groupe fonctionnel ester est obtenu par condensation d'un groupe acide carboxylique et d'un groupe alcool ainsi que formation d'eau :
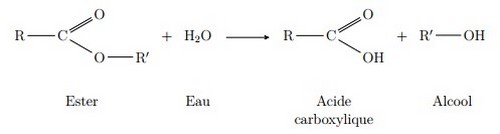
Dans une réaction d'estérification la molécule d'acide perd le groupement -OH et celle d'alcool perd le groupement -H pour conduire à un ester et une molécule d'eau :
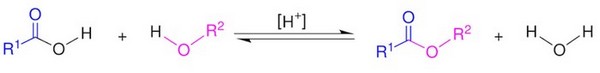
III- Les réactions d’estérification et hydrolyse d’un ester
3-3/ La réaction d'hydrolyse
Une réaction d’hydrolyse d’un ester modélise la transformation spontanée qui conduit à un alcool et à un acide carboxylique à partir d’un ester et d’eau.
C’est l’inverse de l’estérification.
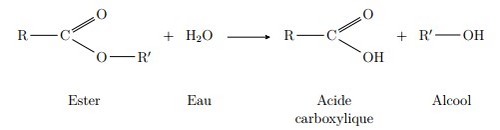
III- Les réactions d’estérification et hydrolyse d’un ester
3-4/ L’expérience de Berthelot
Protocole expérimental
Cette étude a été réalisé par le chimiste français Berthelot en 1862 dont le protocole expérimental est le suivant :
Un mélange équimolaire constitué d'une mole d'éthanol (46g) et une mole d'acide éthanoique (60g) est repartie après homogénéisation dans plusieurs tubes à essaies identiques scellées et placés à température constante .
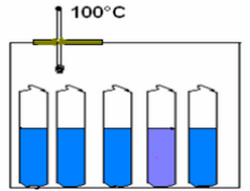
Dans chaque tube démarre l'estérification et les divers échantillons évoluent en parallèle, de façon identique.
Pour déterminer la nombre de moles d'ester formé à un instant t donné, on prélève un tube et on lui fait subir une trempe dans glacée pour arrêter la réaction puis on dose l’acide présent (restant) dans le tube à cet instant t à l’aide d’une solution de soude de concentration connue.
III- Les réactions d’estérification et hydrolyse d’un ester
3-4/ L’expérience de Berthelot
Résultats (estérification)
Soit est le nombre de moles de restant à l'instant t.
représente le nombre de moles de qui a réagit, c'est à dire le nombre de moles d'ester formé à l'instant t.
On obtient les résultats suivants :

Pour obtenir un mélange de composition constante à , on a besoin de 150heures, donc la réaction d'estérification est une réaction lente.
À l'état final la composition du mélange devient constante mais aucun des réactifs n'a disparu, donc la réaction d'estérification est limitée, en plus c’est une réaction endothermique.
III- Les réactions d’estérification et hydrolyse d’un ester
3-4/ L’expérience de Berthelot
Résultats (hydrolyse)
En utilisant la même méthode utilisée dans l'étude de l'estérification, on peut suivre l'évolution de la réaction d'hydrolyse.
en dosant l'acide formé par une base de concentration connue ce qui permet de tracer la courbe de la variation de la quantité de matière d'ester restant en fonction du temps.
La courbe suivante représente la quantité de matière d'ester restant en fonction de temps :
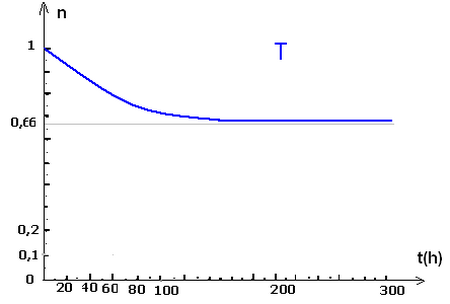
La réaction d'hydrolyse est une réaction lente, limitée et endothermique.
IV- Équilibre chimique : estérification hydrolyse
4-1/ Notion d'équilibre : estérification hydrolyse
La réaction d'estérification et la réaction d'hydrolyse sont deux réactions inverses l'une de l'autre, elles se produisent en même temps et elles conduisent à un équilibre chimique.

Cette transformation est caractérisée par sa constante d'équilibre :
Le quotient de la réaction :
L'utilisation de l'un des réactifs en excès (l'alcool ou bien l'acide) entraîne la diminution du quotient de la réaction , il devient ce qui conduit à l'évolution du système dans le sens direct (sens de l'estérification).
L'élimination de l'un des produits (eau ou bien l'ester) entraîne aussi la diminution du quotient de la réaction , il devient ce qui conduit à l'évolution du système dans le sens direct (sens de l'estérification).
IV- Équilibre chimique : estérification hydrolyse
4-2/ Les facteurs influençant l'équilibre
Influence de la température
Une élévation de température permet d’atteindre plus rapidement la limite de l’équilibre d’estérification-hydrolyse mais ne modifie pas cette limite.

IV- Équilibre chimique : estérification hydrolyse
4-2/ Les facteurs influençant l'équilibre
Influence du catalyseur
Un catalyseur ne modifie pas un état d’équilibre, car il catalyse de la même façon les deux réactions inverses l’une de l’autre.
Il permet d’atteindre plus rapidement cet état.
IV- Équilibre chimique : estérification hydrolyse
4-2/ Les facteurs influençant l'équilibre
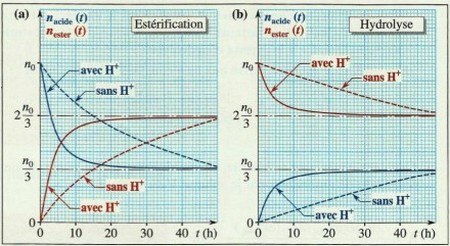
Influence de la nature des réactifs
Le taux d’avancement final d’une estérification dépend très peu de la nature de l’acide carboxylique mis en jeu.
En revanche, il dépend nettement de la classe de l’alcool utilisé.
Ainsi, pour des mélanges stœchiométriques d’acide carboxylique et d’alcool, le taux d’avancement final de la synthèse de l’ester est de :
- 67% si l’alcool est primaire.
- 60% si l’alcool est secondaire.
- 5% si l’alcool est tertiaire.
IV- Équilibre chimique : estérification hydrolyse
4-2/ Les facteurs influençant l'équilibre
Influence des proportions initiales des réactifs
Le taux d’avancement final T, et donc le rendement, de l’estérification sont d’autant plus importants que l’un des réactifs est en fort excès.
Le taux d’avancement final T, et donc le rendement, de l’hydrolyse d’un ester, sont d’autant plus importants que l’un des réactifs, généralement l’eau, est en fort excès.

IV- Équilibre chimique : estérification hydrolyse
4-2/ Les facteurs influençant l'équilibre
Récapitulatif
Influence sur la vitesse de la réaction d'estérification :
Le système chimique atteint son état d'équilibre plus rapidement sans influer sur sa composition finale soit :
- Par élévation de la température.
- En utilisant le catalyseur .
Influence sur l'état final :
Pour déplacer l'équilibre dans le sens de la formation de l'ester et augmenter le rendement de l'estérification on doit soit:
- Éliminer l'un des produits : l’eau ou l’ester.
- Utiliser de l'un des réactifs(l'alcool ou l'acide) en excès.
V- Exercices
5-1/ Exercice 1
On étudie la réaction d’estérification de l’acide méthanoïque avec le pentan-1-ol.
Pour cela on mélange d’acide avec d’alcool et on maintient la température du mélange obtenu à une valeur constante.
- Montrer que le mélange est équimolaire et que le nombre de mole de chacun des deux réactifs est de .
- Écrire l’équation de la réaction d’estérification et donner ses caractères.
On prélève un volume du mélange toutes les 5 minutes, et après refroidissement on dose l’acide restant avec une solution de soude de concentration .
- Établir l’expression de la quantité de matière d’acide restant dans le volume à un instant en fonction de la concentration et du volume de soude versé à l’équivalence.
- Calculer la quantité de matière d’acide contenu initialement dans le volume .
- Déduire l’expression de la quantité de matière d’ester formé dans le volume à un instant en fonction de , et .
Les différents dosages ont permis de tracer la courbe suivante traduisant la variation du nombre de moles d’ester formé au cours du temps :
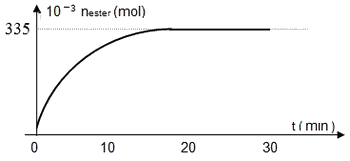
- Déterminer la composition du mélange à un instant .
- Définir et calculer la constante d’équilibre de la réaction d’estérification étudiée.
Données :
- .
- .
V- Exercices
5-2/ Exercice 2
On réalise dans des tubes scellés l’estérification de l’acide méthanoïque avec l’éthanol .
Chacun des tubes contient à l’instant initial de date , une quantité de d’acide méthanoïque et une autre de d’éthanol.
- Écrire l'équation de l'estérification qui se produit.
À chaque heure, on dose avec une solution d’hydroxyde de sodium l’acide restant dans un tube, à l’exception d’un tube noté , ceci permet de tracer la courbe de la figure suivante, traduisant l’évolution temporelle de la quantité de matière na d’acide restant :
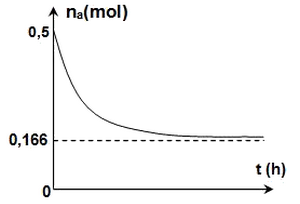
- Dresser le tableau d’avancement de l’estérification qui se produit.
- Calculer le taux d’avancement final de cette estérification.
- En déduire si elle est totale ou limitée.
Le système chimique, siège de cette réaction, est formé d’une seule phase liquide de volume .
- Montrer que la constante d’équilibre de cette estérification est sensiblement égale à .
Le tube dont l’acide restant n’a pas été dosé, contient à un instant , d’acide, d’alcool, d’ester et d’eau.
- Pour que les quantités d’acide, d’alcool et d’ester restent inchangées et égales respectivement à , à partir de l’instant préciser, en le justifiant, si à cet instant l’on doit ajouter de l’eau ou extraire une partie de l’eau formée au cours de l’estérification.
- Déterminer la quantité de matière ne d’eau qu’il faudrait ajouter ou extraire du tube à l’instant .
V- Exercices
5-3/ Exercice 3
Le taux d’avancement final d’une réaction est le rapport .
On donne ce taux d’avancement final dans le cas d’un mélange équimolaire d’alcool et d’acide :
- Pour les alcools primaires :
- Pour les alcools secondaires :
- Dans le cas d’un mélange équimolaire, montrer que la constante d’équilibre s’écrit sous la forme .
- Calculer pour chaque classe d’alcool la constante d’équilibre relative à la réaction d’estérification.
On réalise une réaction d’estérification en mélangeant à un volume d’acide éthanoïque de densité et un volume d’alcool, de densité et de formule brute .
On donne :
- Quelle est la composition initiale du mélange ?
- Déterminer le sens d’évolution spontanée de la réaction.
- Dresser le tableau d’avancement de la réaction.
On prépare 10 tubes à essai propres et secs et à l’aide d’une pipette graduée on verse du mélange obtenu dans chacun d’eux puis on les place dans un bain marie.
Pour déterminer la composition du mélange à , on retire un tube, on le refroidit avec l’eau glacée et on dose l’acide restant par une solution d’hydroxyde de sodium de concentration , on obtient l’équivalence pour un volume de soude versé .
- Déterminer le nombre de mole d’acide à l’instant , en déduire le nombre de mole d’ester formé à cet instant.
- Calculer à le taux d’avancement de la réaction.
- Le système a t-il atteint l’équilibre ? Discuter selon la classe de l’alcool.
On se place dans le cas où le système n’a pas atteint l’équilibre.
- Écrire l’équation de la réaction d’estérification
On considère une deuxième expérience dont le mélange initial est formé de d’acide éthanoïque, d’alcool, d’ester et d’eau.
- Dans quel sens évolue la réaction ?
- Dresser le tableau descriptif d’évolution du système chimique.
- Déterminer la composition du mélange à l’équilibre dynamique.
V- Exercices
5-4/ Exercice 4
On réalise la réaction d’hydrolyse de méthanoate d’éthyle à une température constante de en mélangeant dans un ballon, à la date , une mole de l’ester et une mole d’eau.
On réalise, au cours du temps, des prélèvements de volume grâce auxquels on déduit par titrage avec une solution de soude la quantité de matière n d'acide formé dans le mélange.
Les résultats ont permis de tracer le graphe, de l’évolution de la quantité de matière d’acide formé au cours du temps :
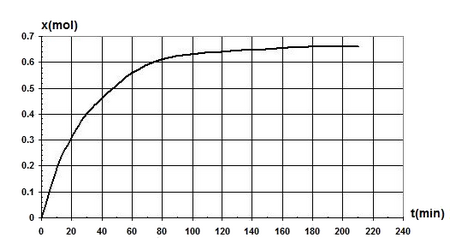
- Écrire l'équation de la réaction d’hydrolyse notée (1).
- Faire le schéma du montage permettant de réaliser le titrage de l'acide formé et nommer le matériel utilisé.
- Dresser le tableau d'évolution de la réaction (1).
- Quel volume de la solution de soude de concentration doit-on verser dans le prélèvement à l'équivalence à la date .
- Déterminer le taux d'avancement final de la transformation et déduire le caractère total ou limité de la réaction (1).
- Déterminer la valeur de la constante d’équilibre relative à cette réaction.
On réalise de nouveau la réaction d’hydrolyse du l'acide méthanoate d’éthyle à la même température de en mélangeant, à la date , une mole de l’ester et deux moles d’eau.
- Déterminer le taux d'avancement final de cette réaction dans ces conditions.
- Quelle conclusion peut-on tirer pour augmenter le taux d'avancement final d'une réaction d’hydrolyse ?


