
Physique et Chimie : 2ème Année Bac
Séance 25 (Transformations forcées (Électrolyse))
Professeur : Mr El GOUFIFA Jihad
Sommaire
I- Transformations spontanées
1-1/ Rappel
1-2/ Exemple (Transformation spontanée entre le cuivre métal et le dibrome en solution aqueuse)
II- Transformations forcées
2-1/ Définition
2-2/ Exemple (Électrolyse d'une solution de bromure de cuivre )
III- Autres exemples d'électrolyses
3-1/ Électrolyse d'une solution de chlorure de sodium
3-2/ Électrolyse à anode soluble
IV- Applications de l'électrolyse
V- Exercices
5-1/ Exercice 1
5-2/ Exercice 2
5-3/ Exercice 3
I- Transformations spontanées
1-1/ Rappel
Une transformation spontanée est une transformation qui se produit sans aucune intervention extérieure.
Le sens du courant débité correspond à l’évolution spontanée du système.
I- Transformations spontanées
1-2/ Exemple (Transformation spontanée entre le cuivre métal et le dibrome en solution aqueuse)
On mélange dans un tube à essaie la tornure de cuivre et une solution de dibrome de concentration .
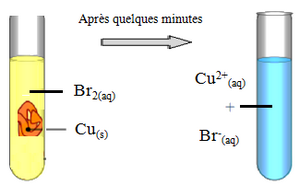
La solution initiale est rouge-orange (couleur du dibrome en solution).
On constate :
- la disparition de la coloration du dibrome .
- la dispatition du métal cuivre.
- la solution se colore progressivement en bleu (cette coloration est due à l'apparition des ions ).
Une réaction d’oxydo-réduction s’est produite spontanément entre et avec formation des ions et selon l'équation suivante :
À , la constante d'équilibre qui lui est associée vaut .
Le quotient de réaction dans l’état initial de ce système vaut :
D'après le critère d'évolution spontanée, le système va évoluer dans le sens direct de l'équation.
la réaction est presque totale dans le sens direct de l'équation.
II- Transformations forcées
2-1/ Définition
Une transformation est dite forcée, si elle se déroule dans le sens opposée de la transformation spontanée.
L’électrolyse est un exemple de cette transformation.
II- Transformations forcées
2-2/ Exemple (Électrolyse d'une solution de bromure de cuivre )
On remplit un tube en U avec une solution de bromure de cuivre et on réalise le montage suivant en utilisant deux électrodes de graphite :
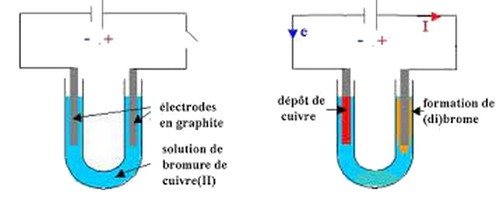
Pour une tension supérieure à 1,2V on constate la formation d'un dépôt de cuivre sur la cathode et formation du dibrome au voisinage de l'anode.
L'électrode liée au pôle positif du générateur s'appelle l'anode et celle liée au pôle négatif s'appelle la cathode.
| L'anode | La cathode | |
| Cas de la pile | Pôle négatif | Pôle positif |
| Cas de l'électrolyse | Pôle positif | Pôle négatif |
II- Transformations forcées
2-2/ Exemple (Électrolyse d'une solution de bromure de cuivre )

Pendant l'électrolyse, le courant électrique passe de l'anode (pôle positif) vers la cathode (pôle négatif) et les électrons circulent dans le sens contraire.
Au voisinage de l'anode se produit l'oxydation des ions selon la demi-équation suivante :
Au voisinage de la cathode se produit la réduction des ions selon la demi-équation suivante :
Bilan de l'électrolyse : qui est l'inverse de la réaction précédente.
Conclusion
L'expérience montre que si le générateur fournit l'énergie nécessaire, le système peut évoluer dans le sens contraire de celui de la transformation spontanée : cette transformation forcée s'appelle l'électrolyse.
III- Autres exemples d'électrolyses
3-1/ Électrolyse d'une solution de chlorure de sodium
On introduit dans un tube en U une solution aqueuse de chlorure de sodium .
Deux électrodes en graphite plongées dans la solutions et reliées chacune à l'une des bornes (positive ou négative) d'un générateur de tension continue .
Après plusieurs minutes de fonctionnement, on constate :
- À l’anode, il s'est formé un dégagement gazeux de dichlore (Décoloration de l’indigo initialement bleu).
- À la cathode, il s'est formé un dégagement de dihydrogène (détonation en présence d’une flamme) et il est apparu des ions hydroxyde (Phénolphtaléine prends une coloration rose).
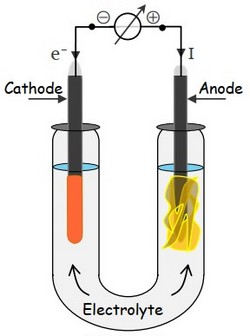
Les réactions qui se produisent au niveau des électrodes :
- À l’anode :
- À la cathode :
Équation bilan de l’électrolyse d’une solution aqueuse de :
III- Autres exemples d'électrolyses
3-2/ Électrolyse à anode soluble
Intérêt de l’électrolyse à anode soluble
On rencontre ce type d'électrolyse si l'anode est constituée d'un métal et la solution électrolytique contient les ions de ce même métal (qui constitue l'anode).
Le métal de l'anode s'oxyde selon la demi-équation :
Le métal se dépose sur la cathode par réduction des ions selon la demi-équation :
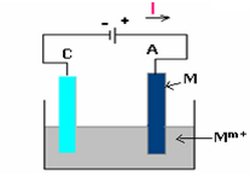
Le bilan de la réaction est nul et cette électrolyse commence à partir de 0V.
L’intérêt de cette électrolyse est le transfert du métal de l'anode vers la cathode (On l’utilise pour la réalisation de dépôt de métal sur un support métallique ou pour la purification des métaux).
III- Autres exemples d'électrolyses
3-2/ Électrolyse à anode soluble
Exemple
On réalise l'électrolyse d'une solution de sulfate de cuivre :
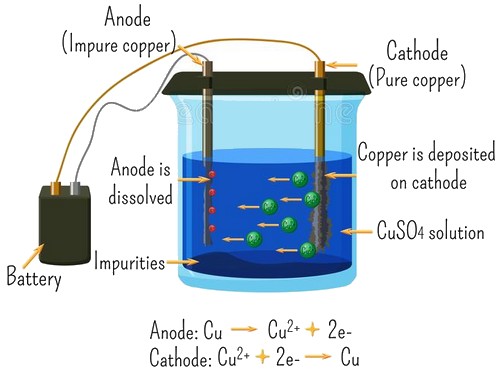
Bilan de l'électrolyse : Transfert du cuivre de l'anode vers la cathode.
IV- Applications de l'électrolyse
Malgré le coût élevé de l'énergie électrique consommée ,l'électrolyse a de nombreuses applications industrielles comme :
- La préparation et la purification de nombreux métaux comme l'aluminium,le zinc,le cuivre, l'argent et d'autres métaux.
- La préparation d'eau oxygénée ou du dichlore ou du dihydrogène,...
- La protection avec une couche d’or ou d’argent ou par d’autres métaux qui se dépose à la surface de divers objets pour améliorer leurs aspects.
- La recharge des accumulateurs des voitures ou de téléphone sont des applications courantes de l'électrolyse.
V- Exercices
5-1/ Exercice 1
L'électrolyse permet d'obtenir des gaz d'une grande pureté. On réalise l'électrolyse d'une solution concentrée de chlorure de sodium en utilisant deux électrodes en graphite.
On obtient un dégagement de dichlore au voisinage de l’une des électrodes, et dégagement de dihydrogène au voisinage de l'autre électrode, de plus que le milieu réactionnel devient basique au cours de la transformation chimique.
La figure suivante représente le dispositif expérimental utilisé pour réaliser cette électrolyse :
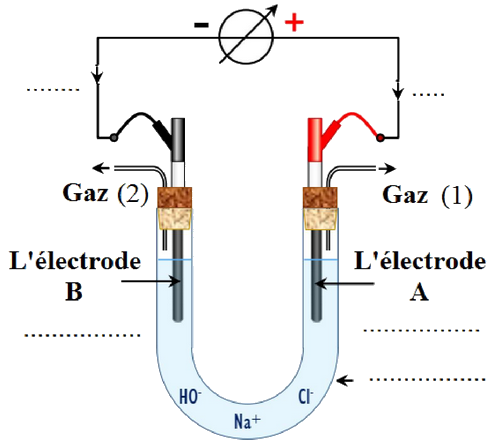
Données :
- Le faraday :
- Le volume molaire dans les conditions de l’expérience :
Les espèces chimiques présentes dans l'électrolyseur sont le graphite , l'eau , les ions
chlorure , les ions sodium . Le graphite est inerte.
Les couples d'oxydoréduction susceptibles d'intervenir sont : , , et
- Compléter la figure.
- Écrire l’équation (ou les demi- équations) modélisant la réaction ayant lieu au voisinage de chaque électrode (les demi-équations possibles).
- En se basant sur les observations expérimentales, écrire l’équation bilan modélisant la transformation ayant lieu au cours de l’électrolyse.
- Identifier le gaz 1 et le gaz 2.
Le générateur alimente le circuit électrique par un courant d’intensité constante pendant une durée .
- Calculer la quantité d’électricité débitée au cours de cette durée.
- Déterminer le volume du dichlore produit au cours de la durée de fonctionnement de l’électrolyseur.
V- Exercices
5-2/ Exercice 2
Parmi les applications de l’électrolyse, on trouve la couverture des métaux par une fine couche d’un métal afin de les protéger de la corrosion ou de les embellir.
L’objectif de cette partie de l’exercice est d’étudier l’argenture d’une plaque de cuivre par électrolyse.
Données :
- Les couples mis en jeu : et .
- Le faraday :
- Masse molaire atomique de l’argent:
On plonge totalement une plaque de cuivre dans une solution de nitrate d’argent et on relie par un fil conducteur à l'une des deux bornes d'un générateur . L'autre borne est reliée à une électrode de graphite comme l’indique la figure suivante :
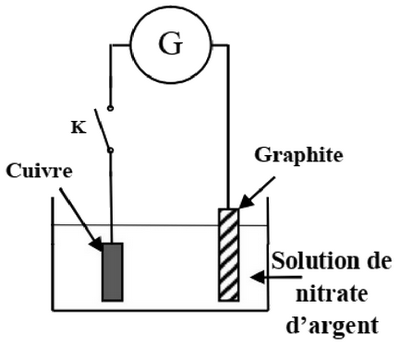
Lors de la fermeture de l’interrupteur , le générateur délivre au circuit un cornant électrique, d’intensité constante , pendant une durée .
Le gaz dioxygène se dégage au niveau de l’électrode de graphite et le métal argent se dépose uniformément sur la plaque de cuivre.
On considère que les ions nitrate ne réagissent pas au cours de l’électrolyse.
- Choisissez, parmi les réponses proposées, la réponse juste sans aucune explication ni justification.
A- Au cours de l’argenture par électrolyse :
- La plaque de cuivre représente l’anode, elle est reliée à la borne négative du générateur .
- La plaque de cuivre représente l’anode, elle est reliée à la borne positive du générateur .
- La plaque de cuivre représente la cathode, elle est reliée à la borne négative du générateur .
- La plaque de cuivre représente la cathode, elle est reliée à la borne positive du générateur .
B- L’équation chimique de la réaction à l’électrode de graphite s’écrit sous la forme :
C- La masse de l’argent déposé sur la plaque de cuivre pendant la durée est :
D- Le volume de dioxygène dégagé pendant la durée sachant que le volume molaire dans les conditions de l’expérience est est :
V- Exercices
5-3/ Exercice 3
C’est par oxydation que le cuivre se recouvre de « vert de gris ». La couche obtenue donne un aspect particulier aux statues, mais elle est constituée d’un sel soluble qui est toxique. L’électrolyse du cuivre consiste dans ce cas à déposer une fine couche d’étain sur toute la surface du récipient. Ce procédé est appelé étamage. L’électrolyte est constitué de sulfate d’étain, et de différents additifs. Le récipient à étamer constitue une électrode, l’autre étant de l’étain pur.
On considère le schéma du montage suivant :
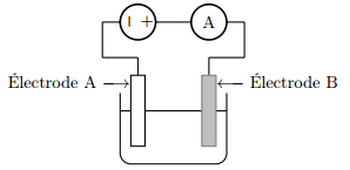
- Indiquer sur ce schéma le sens du courant électrique dans le circuit ainsi que le sens de circulation des porteurs de charge dans les conducteurs métalliques et dans la solution.
- L’électrolyse est-elle une transformation spontanée ? Justifier la réponse.
On étudie les réactions aux électrodes en considérant que le solvant n’intervient pas.
- La réaction se produisant à l’électrode reliée à la borne négative du générateur est-elle une oxydation ou une réduction ? Justifier. En déduire le nom de chaque électrode.
- Écrire l’équation de la réaction ayant lieu à l’électrode . Le récipient à recouvrir doit-il constituer cette électrode ? Justifier.
- Écrire l’équation de la réaction ayant lieu à l’autre électrode .
- En déduire l’équation de la réaction globale de cette électrolyse. Comment évolue la concentration en ions étain dans la solution au cours de la réaction ?
L’intensité du courant électrique est maintenue constante pendant toute la durée de l’électrolyse.
- Donner l’expression de la quantité d’électricité qui a traversé le circuit au cours de l’électrolyse.
- En s’aidant éventuellement d’un tableau d’avancement, établir la relation entre la quantité d’électrons échangée et la quantité d’étain déposé sur le récipient.
- Donner la relation entre la quantité d’électricité et la quantité d’électrons échangés aux électrodes.
- Montrer alors que la durée de l’électrolyse peut être exprimée, en fonction de la masse déposée, par la relation : .
On veut étamer une casserole cylindrique, de diamètre , de hauteur , et d’épaisseur négligeable. Le dépôt d’étain doit être réalisé sur les faces interne et externe et sur une épaisseur .
- Calculer la valeur de en .
- La masse volumique de l’étain est . Calculer la masse d’étain nécessaire.
- Calculer la durée minimale de l’électrolyse pour réaliser ce dépôt.
Données :
- Masse molaire de l’étain :
- Constante de Faraday :
- Le couple


