
Physique et Chimie : 3ème Année Collège
Séance 2 (Les atomes et les ions)
Professeur : Mr El GOUFIFA Jihad
Sommaire
I- Structure de l’atome
1-1/ Évolution du modèle de l’atome
1-2/ Constituants de l’atome
1-3/ Le noyau
1-4/ Les électrons
1-5/ Exemples
II- Neutralité électrique d'une atome
III- Formation des ions
3-1/ Définition
3-2/ Cations et anions
3-4/ Ions polyatomiques
IV- Exerccies
4-1/ Exercice 1
4-2/ Exercice 2
4-3/ Exercice 3
4-4/ Exercice 4
I- Structure de l’atome
1-1/ Évolution du modèle de l’atome
La notion d’atome n'est pas récente, elle est apparue an 5e siècle avant JC, grâce à Démocrite, philosophe grec. II considérait que la matière était constituée de petites particules invisibles et insécables (qui ne pouvaient être coupées).
Cette théorie fut oubliée jusqu’au début du 19e siècle. Alors des scientifiques, Dalton, puis Thomson et enfin Rutherford réaffirment l'existence de l’atome et en démontrent la structure.

I- Structure de l’atome
1-2/ Constituants de l’atome
Un atome est constitué d’un noyau placé au centre de l’atome qui renferme des charges positives, autour duquel tournent des électrons qui renferment des charges négatives.
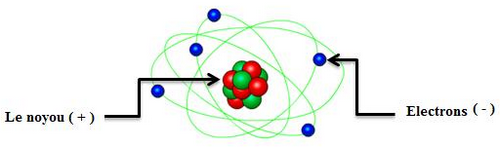
I- Structure de l’atome
1-3/ Le noyau
Placé au centre de l’atome, est chargé positivement.
La forme : le noyau possède une forme sphérique.
Situation : il se situe au centre de l’atome.
Taille : il est environ 100 000 fois plus petit que l’atome auquel il appartient.
Le nombre de charge positives du noyau est représenté par la lettre Z appelé le numéro atomique.
Presque toute la masse de l’atome se trouve dans le noyau.
I- Structure de l’atome
1-4/ Les électrons
Chaque électron porte une seule charge négative. q = -1,6. 10-19C = -e
Ils sont tous identiques.
Ils forment le nuage électronique.
La taille : les électrons sont nettement plus petits que le noyau.
Situation : ils sont mobiles et tournent autour du noyau.
Charge électrique : chaque électron possède une charge électrique négative.
Tous les électrons sont identiques même s’ils appartiennent à des atomes différents.
La masse des électrons est très faible par rapport à celle du noyau.
I- Structure de l’atome
1-5/ Exemples
Remarque
L’atome est électriquement neutre : le nombre de charges positives du noyau est donc égal au nombre de charges négatives des électrons.
II- Neutralité électrique d'une atome
Un atome est électriquement neutre.
Le nombre de charges positives du noyau est donc égal au nombre de charges négatives des électrons.
Ce nombre est appelé le numéro atomique Z de l’atome; il sert à classer les atomes.
- Charge totale du noyau : .
- Charge totale des électrons : .
Conséquence
Si l'on connaît le nombre de charges positives dans un noyau, on connaît aussi le nombre d’électrons.
Si l'on connaît le nombre d’électrons on connaît aussi le nombre de charges positives dans le noyau.
Si un composé porte une charge électrique globalement positive ou négative, il ne s’agit pas d’un atome (il s’agit d’un ion).
III- Formation des ions
3-1/ Définition
Un ion est un atome ou groupe d’atomes qui a perdu ou gagné un ou plusieurs électrons.
Remarque
Un ion monoatomique est un atome ayant perdu ou capturé un ou plusieurs électrons.
Un ion polyatomique est un groupe d’atome ayant perdu ou capturé un ou plusieurs électrons.
III- Formation des ions
3-2/ Cations et anions
Les cations
Un cation est un ion positif. Il s'agit donc d'atome (ou d'un groupe d’atome) qui a perdu un ou plusieurs électrons.
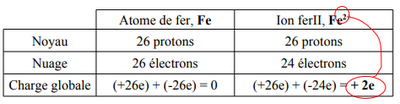
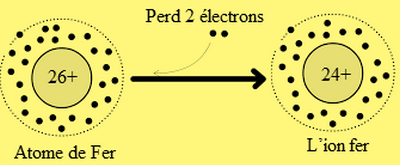
Exemple : un atome de fer, Fe, (Z = 26) perd 2 électrons et devient un ion fer II noté .
III- Formation des ions
3-2/ Cations et anions
Les anions
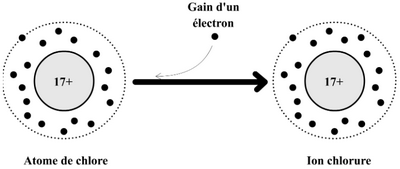
Un anion est un ion négatif. Il s'agit donc d'atome (ou d'un groupe d’atome) qui a gagné un ou plusieurs électrons.
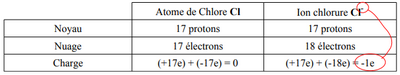
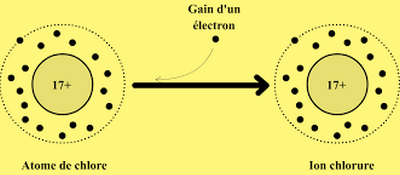
Exemple : atome de chlore Cl (Z = 17) gagne un électron et devient l'ion chlorure noté .
III- Formation des ions
3-4/ Ions polyatomiques
Certains ions sont constitués par l’association de plusieurs atomes de types différents ; dans ce cas, c’est le groupe d’atomes qui a perdu ou gagné un ou plusieurs électrons.
La charge positive ou négative s’applique à l’ensemble des atomes du groupe.
Exemple
L'ion sulfate groupement formé d'un atome de soufre (S) et 4 atomes d'oxygène (O) ayant gagné 2 électrons.
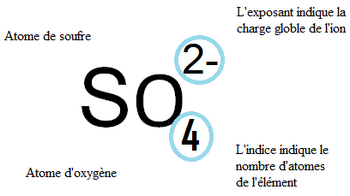
Autres exemples
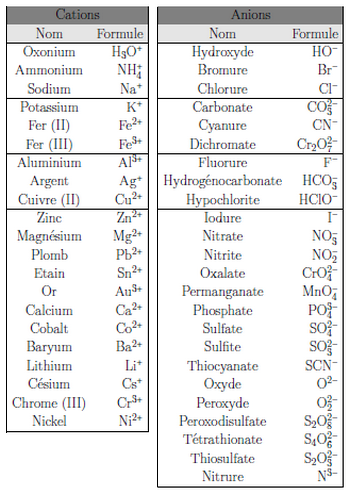
IV- Exerccies
4-1/ Exercice 1
Compléter le tableau suivant :

IV- Exerccies
4-2/ Exercice 2
Répondre par Vrai ou Faux :
- Les électrons sont différents dans les atomes. : __________
- L’électron a la même masse dans tous les atomes. : __________
- Dans l’atome, le nombre de charges des électrons est plus grand que le nombre de charges dans le noyau. : __________
- Le noyau porte une charge négative. : __________
- La charge électrique des électrons est +Ze. : __________
- Le noyau est la même dans tous les atomes. : __________
- Les électrons contiennent la matière de l’atome. : __________
Compléter les phrases suivantes :
- L’atome est constitué de ______________ qui sont des petites ______________ qui tournent autour du ______________ en formant un ______________ électronique.
- Chaque atome est caractérisé par un nombre ______________ appelé ______________ ______________ . Il indique aussi le nombre de ______________ dans le noyau.
- Les électrons portent une charge électrique ______________ par contre le noyau porte une charge ______________ et la charge de l’atome est ______________ car il est électriquement ______________
- Le symbole d’électron est ______________ et sa charge électrique est ______________ .
IV- Exerccies
4-3/ Exercice 3
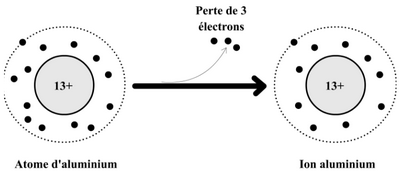
Le numéro atomique d’aluminium Al est Z = 13.
- Déterminer le nombre d'électrons de l'atome d’aluminium.
- Calculer la charge des électrons des atomes d’aluminium en e et en Colomb.
- Calculer la charge du noyau de l’atome d’aluminium en termes de e, puis en Colomb.
Dans certaines conditions expérimentales, l’atome d’aluminium perd trois électrons et se transforme en un ion d’aluminium.
- Écrire la formule des ions d’aluminium et donne-en le type et la nature.
- Calculer le nombre d'électrons d'ions d’aluminium.
- Calculer la charge des électrons d'ions d’aluminium en termes de e et de Colomb.
- Calculer la charge totale d’ion d’aluminium en e et en Colomb.
IV- Exerccies
4-4/ Exercice 4
Le produit de réaction entre le sodium et le chlore est : Le chlorure de sodium NaCl
Au cours de cette réaction un atome de sodium perd un électron en faveur d’un atome de chlore.
Le numéro atomique de l’atome de sodium est Z =11
La charge des électrons de l’ion chlorure est
- Donner le symbole de l’ion sodium et le symbole de l’ion chlorure.
- Donner la charge des électrons de l’ion sodium en fonction de e.
- Donner la charge du noyau de l’ion sodium en fonction de e.
- Déterminer le nombre d’électrons de l’atome de chlore.
- Donner la charge du noyau de l’atome de chlore en fonction de e.


