
Physique et Chimie : 1ère Année Bac
Séance 9 (Mesure des quantités de matière en solution par conductimétrie)
Professeur : Mr EL GOUFIFA Jihad
Sommaire
I- Conduction dans les solutions aqueuses
II- Conductance d’une solution ionique
2-1/ Solution électrolytique
2-2/ Cellule de mesure de la conductance (Cellule conductimétrique)
2-3/ Résistance et conductance électrique
III- Facteurs influençant la conductance
3-1/ Influence des caractéristiques géométriques de la cellule
3-2/ Influence des caractéristiques de la solution
3-3/ Courbe d’étalonnage
IV- La conductivité d’une solution électrolytique
4-1/ Relation entre la conductance et la conductivité
4-2/ Facteurs influençant la conductivité
4-3/ Conductivité molaire ionique d’un ion
4-4/ Conductivité d’une solution
V- Exercices
5-1/ Exercice 1
5-2/ Exercice 2
5-3/ Exercice 3
5-4/ Exercice 4
I- Conduction dans les solutions aqueuses
Expérience
On réalise le montage suivant :

On constate que :
Les cations caractérisés par la couleur bleue migrent vers la cathode (borne négative du générateur), ce sont des cations.
Les anions caractérisés par la couleur violette migrent vers l’anode (borne positive du générateur), ce sont des anions.
Conclusion
Dans les solutions aqueuses, le passage du courant électrique est dû à un déplacement d’ions : les ions positifs (cations) se déplacent dans le sens conventionnel du courant (vers la borne - du générateur) et les ions négatifs (anions) dans le sens contraire (vers la borne + du générateur).
II- Conductance d’une solution ionique
2-1/ Solution électrolytique
Les corps purs solides qui se dissolvent dans des solvants en donnant des ions sont des "Électrolytes" :
La solution est formée d'ions stabilisés par le solvant et une telle solution conduit le courant électrique car les ions peuvent migrer sous l'action d'un champ électrique.
II- Conductance d’une solution ionique
2-2/ Cellule de mesure de la conductance (Cellule conductimétrique)
La cellule de mesure de conductance est constituée de deux plaques métalliques planes, de même surface , parallèles, disposées l’une en face de l’autre et séparées par une distance .
Si on plonge les électrodes de la cellule dans une solution électrolytique, on peut mesurer la conductance .
Le volume de liquide compris entre les électrodes :

II- Conductance d’une solution ionique
2-3/ Résistance et conductance électrique
La conductance d'une solution exprime son aptitude à conduire le courant électrique, elle est égale à l’inverse de la résistance.
Pour mesurer la conductance d’une solution électrolytique, il suffit de mesurer la tension entre les plaques de la cellule (plongées dans la solution) et l’intensité du courant qui traverse la solution.
La portion de la solution qui se trouve entre les deux plaque se comporte comme un dipôle de résistance , et sa conductance est (en Siemens S)

III- Facteurs influençant la conductance
3-1/ Influence des caractéristiques géométriques de la cellule
Pour une solution donnée, la conductance augmente quand :
- La surface d’une électrode augmente.
- La distance entre les électrodes diminue.
La conductance est proportionnelle à la surface des électrodes et inversement proportionnelle à la distance qui les séparent.
III- Facteurs influençant la conductance
3-2/ Influence des caractéristiques de la solution
La concentration
La conductance de la solution augmente avec sa concentration molaire.
Nature de l’électrolyte
La conductance d’une solution dépend de la nature du soluté, c’est-à-dire des ions présents dans la solution.
La température
La conductance d’une solution augmente avec sa température.
III- Facteurs influençant la conductance
3-3/ Courbe d’étalonnage
A la même température, on mesure la conductance pour des solutions de chlorure de sodium de concentrations connues afin de tracer la courbe d’évolution de la conductance en fonction de la concentration.
Le tableau suivant fournit la conductance des différentes solutions :
| Solution | ||||||
| 2,5 | 5,0 | 7,5 | 10 | 12,5 | 15 | |
| 0,75 | 1,5 | 2,25 | 3 | 3,75 | 4,5 |

On est en présence d’une fonction linière, son équation s’écrit :
: dépend des caractéristiques de la cellule et de la nature du soluté.
La courbe est appelée courbe d’étalonnage, elle permet de déterminer la concentration inconnue d’une solution de même soluté, en mesurant sa conductance.
Cette formule n’est valable que pour les solutions diluées :
IV- La conductivité d’une solution électrolytique
4-1/ Relation entre la conductance et la conductivité
La conductance G d’une solution électrolytique est proportionnelle au rapport :
- : la conductance en Siemens (S)
- : la conductivité de la solution (S.m-1)
- : la surface des électrodes (m2)
- : la distance séparant les deux électrodes (m)
Le coefficient de proportionnalité représente la conductivité de la solution.
La grandeur est liée à la nature et la concentration des ions présents dans la solution.
Remarque
La conductance peut s’exprimer en avec .
La constante s’appelle la constante de la cellule, son unité est (m).
IV- La conductivité d’une solution électrolytique
4-2/ Facteurs influençant la conductivité
La conductivité augmente quand :
- la concentration de la solution augmente.
- la température de la solution augmente.
Elle dépend aussi de la nature des ions présents dans la solution.
IV- La conductivité d’une solution électrolytique
4-3/ Conductivité molaire ionique d’un ion
La conductivité d’un ion est proportionnelle à sa concentration pour des valeurs inférieures à :
Le coefficient de proportionnalité est appelé conductivité molaire ionique, son unité est le .
La conductivité molaire ionique dépend de la température, de la nature du solvant et de l’ion considéré.
Conductivité molaire ionique de quelques ions
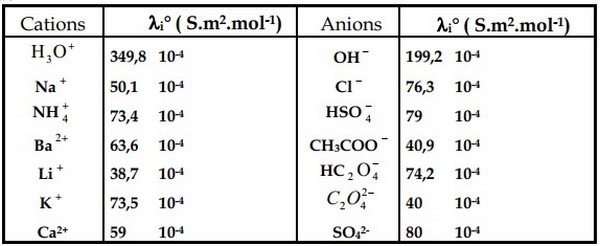
Les ions et ont une conductivité molaire ionique nettement plus grande que celle des autres ions, donc leur présence dans une solution confère à celle-ci une conductivité importante.
IV- La conductivité d’une solution électrolytique
4-4/ Conductivité d’une solution
Pour une solution diluée contenant des ions et dont les concentrations sont
notées et , la conductivité peut s’écrire sous la forme :
Plus généralement la conductivité d’une solution ionique contenant plusieurs ions est :
avec en , et en , et en
V- Exercices
5-1/ Exercice 1
On prélève d’une solution d’acide chlorhydrique de concentration que l’on met dans un bécher.
On dilue de manière à obtenir un volume total de .
- Déterminer la concentration des ions après dilution.
- Quelle est la conductivité de la solution contenue dans le bécher ?
On ajoute à ce bécher de chlorure de sodium qu’on dissout totalement après agitation.
- Déterminer la nouvelle conductivité de la solution.
Données :
- Masses molaires : .
- Mobilités des ions suivants (SI) :
V- Exercices
5-2/ Exercice 2
Pour étalonner une cellule conductimétrique, on utilise une solution étalon de chlorure de potassium de concentration à la température de .
On mesure la tension aux bornes de la cellule et l’intensité du courant qui la traverse, et on trouve et .
- Exprimer puis calculer la conductance G en mS de la portion de solution comprise entre les électrodes.
- Exprimer la conductimétrie de la solution en fonctions des conductivités molaires ioniques des ions présents et de leur concentration. Calculer .
- Calculer la constante de la cellule en unités SI.
Les plaques de la cellule sont séparés d’une distance .
4)Quelle est leur surface ?
Données :
V- Exercices
5-3/ Exercice 3
On plonge totalement une cellule conductimétrique constituée de deux plaques parallèles (de surface ) distantes de dans une solution ionique.
La tension appliquée entre les deux électrodes de la cellule est et l’intensité électrique mesurée est .
- Déterminer la résistance et la conductance de la portion de solution comprise entre les deux électrodes.
- Déterminer la conductivité de la solution.
- Quelle serait la valeur de la conductance si on immergeait à moitié les électrodes dans la même solution ?
- Quelle serait la valeur de la conductance si on divisait par 2 la distance séparant les électrodes totalement immergées dans cette même solution ?
V- Exercices
5-4/ Exercice 4
On dispose d’un volume d’une solution aqueuse de chlorure de potassium et d’un volume d’une solution aqueuse de chlorure de sodium.
La concentration molaire de la solution est égale à et la concentration molaire de la solution est égale à .
- Calculer les conductivités et de chacune de ces solutions.
On mélange ces deux solutions.
- Calculer la concentration molaire de chaque ion dans le mélange.
- Calculer la conductivité du mélange.
- Quelle serait la valeur de la conductance mesurée à l’aide d’électrodes de surface , distantes de ?
Données :


