
Physique et Chimie : 1ère Année Bac
Séance 4 (Grandeurs physiques liées aux quantités de matière)
Professeur : Mr EL GOUFIFA Jihad
Sommaire
I- Définitions
II- Quantité de matière d’un solide et d’un liquide
2-1/ Définition de la quantité de matière
2-2/ Quantité de matière et masse
2-3/ Quantité de matière et volume
2-4/ Quantité de matière et densité
III- Quantité de matière d’un gaz
3-1/ Rappels
3-2/ Loi de Boyle-Mariotte
3-3/ Température absolue
3-4/ Équation d’état des gaz parfaits
3-5/ Densité d'un gaz par rapport à l'air
IV- Exercices
4-1/ Exercice 1
4-2/ Exercice 2
4-3/ Exercice 3
4-4/ Exercice 4
I- Définitions
La mole
Une mole est un paquet de entités chimiques identiques.
Le nombre dAVOGADRO
Le nombre représente le nombre d'entités élémentaires par mol, on l'exprime en .
La masse molaire atomique
La masse molaire atomique est la masse d'une mole d'atomes de l'espèce considérée.
On symbolise la masse molaire par , et elle s'exprime en .
La masse molaire moléculaire est la masse d'une mole de molécules de l'espèce considérée, elle s'obtient en faisant la somme des masses molaires atomiques des atomes qui constituent la molécule)
Exemples :
I- Définitions
La masse volumique
C'est la masse en de de la substance.
Elle est définie comme le quotient de la masse d’un corps par son volume :
- : Masse de l'échantillon considéré en
- : Volume occupé par l’échantillon en
- : Masse volumique de l'échantillon en
On exprime aussi les masses volumiques en .
La densité d’un liquide
La densité d’un liquide par rapport à l'eau est égale au rapport entre la masse d’un volume du liquide et la masse d'un même volume d'eau :
- : Masse d'un volume du liquide
- : Masse d'un même volume d'eau
La densité est un nombre qui s’exprime sans unité.
Connaissant la masse volumique du liquide, on peut utiliser la relation suivante :
II- Quantité de matière d’un solide et d’un liquide
2-1/ Définition de la quantité de matière
En chimie, la quantité de matière correspond à un nombre fixé d’éléments (atomes, molécules, ions…).
Une mole est le nombre d’éléments contenus dans de carbone 12. C’est l’unité de quantité de matière.
Le nombre d’éléments dans une mole est le nombre d’Avogadro :
La quantité de matière d’un échantillon est le rapport du nombre d’élément qu’il contient sur le nombre d’Avogadro :
II- Quantité de matière d’un solide et d’un liquide
2-2/ Quantité de matière et masse
La quantité de matière d’un échantillon de masse et de masse molaire est définie par la relation :
Cette relation s'applique pour les solides les liquides (et même pour les gaz), mais il est plus commode de caractériser un gaz par son volume que par sa masse.
Exemple
Déterminer la quantité de matière contenue dans 11,2g d'acide sulfurique .
On donne : .
II- Quantité de matière d’un solide et d’un liquide
2-3/ Quantité de matière et volume
Considérons un échantillon de liquide de volume , de masse volumique et de masse molaire .
Avec la relation , on en déduit la quantité de matière de l'échantillon par la relation
suivante :
Attention aux unités : La masse molaire s'exprime en . Il faut que les unités de masse et de volume soient cohérentes.
Exemple
L’hexane est un liquide incolore formé de molécule de formule et dont la masse volumique est .
Déterminer la valeur du volume nécessaire pour obtenir d'hexane.
II- Quantité de matière d’un solide et d’un liquide
2-4/ Quantité de matière et densité
La densité d’un solide (ou d’un liquide) est égale au quotient de la masse de ce corps par la masse du même volume d’eau :
On a donc :
III- Quantité de matière d’un gaz
3-1/ Rappels
Les gaz sont expansibles (ils occupent tout le volume offert). Ils sont compressibles.
Tous les gaz ont une structure moléculaire.
Les molécules se déplacent dans toutes les directions de façon désordonnée.
Pour déterminer la quantité de matière d'un échantillon de gaz, il faut connaître sa température, son volume et sa pression.
III- Quantité de matière d’un gaz
3-2/ Loi de Boyle-Mariotte
Expérience
On utilise une seringue liée à un manomètre.
On fait varier le volume d'une quantité d'air et on mesure la pression du gaz enfermé dans la seringue et dans chaque cas on indique le volume correspondant :
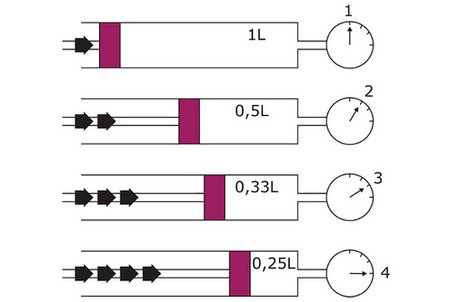
L’expérience montre que le produit PV est constant.
III- Quantité de matière d’un gaz
3-2/ Loi de Boyle-Mariotte
Énoncé de la loi de Boyle-Mariotte
À température constante, pour une quantité de matière donnée de gaz, le produit de la pression P par le volume V de ce gaz ne varie pas :
III- Quantité de matière d’un gaz
3-3/ Température absolue
Le graphe suivant illustre la variation la pression d'une quantité de gaz à volume constant en fonction de la température :
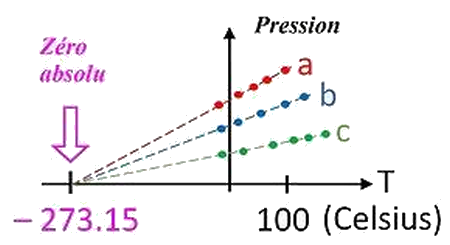
En prolongeant la courbe jusqu'à ce qu'elle se coupe avec l'axe de la température centésimale, on constate que la pression s'annule (théoriquement) lorsque la température est .
La température correspond à l'origine de l'échelle de température absolue, c'est-à-dire zéro kelvin.
III- Quantité de matière d’un gaz
3-4/ Équation d’état des gaz parfaits
Un gaz est dit parfait si les interactions entre les molécules qui le constituent sont très faibles.
Donc les molécules d'un gaz parfait sont très éloignées entre elles, et par conséquence un gaz réel peut jouer le rôle d'un gaz parfait à faible pression et haute température.
Relation des gaz parfaits :
- P : la pression du gaz en pascal
- V : le volume du gaz
- n : la quantité de matière du gaz
- T : la température absolue du gaz
- R : la constante des gaz parfait, sa valeur dans le système international est
Cette relation permet de déterminer la quantité de matière d’un échantillon de gaz connaissant sa température son volume et sa pression.
III- Quantité de matière d’un gaz
3-5/ Densité d'un gaz par rapport à l'air
La densité d’un gaz par rapport à l’air, est égale au quotient de la masse d’un volume de gaz par la masse du même volume d’air ( et étant mesurées dans les mêmes conditions de température et de pression) :
Dans les conditions normales : et
Donc :
IV- Exercices
4-1/ Exercice 1
Le composant essentiel du savon a pour formule .
- Quelle est la masse molaire du savon ?
- Quelle est la quantité de matière en savon dans une savonnette de 125 g ?
Données :
IV- Exercices
4-2/ Exercice 2
A , l’hexane de formule chimique est un liquide de masse volumique égale à .
On a besoin d’un échantillon de d’hexane à .
- Calculer la masse molaire de l’hexane.
- Exprimer puis calculer la masse de l’échantillon d’hexane.
- Exprimer puis calculer le volume d’hexane à prélever pour obtenir la quantité voulue.
- Donner le matériel à utiliser pour le prélèvement.
IV- Exercices
4-3/ Exercice 3
Deux récipients sont reliés par un tube de volume négligeable muni d’un robinet.
Les 2 récipients contiennent un gaz parfait.
La température de ne varie pas pendant l’expérience.
La pression et le volume (récipient 1) sont respectivement : et .
La pression et le volume (récipient 2) sont respectivement : Pa et .
- Calculer les quantités de matière et de gaz dans chaque récipient.
On ouvre le robinet.
- En déduire le volume total occupé par le gaz.
- Déterminer , la pression du gaz lorsque le robinet est ouvert.
IV- Exercices
4-4/ Exercice 4
Le volume molaire gazeux vaut .
- Calculer la quantité de matière de dioxyde de carbone contenue dans de ce gaz
- Évaluer le nombre de molécules de dioxyde de carbone.
- Quelle est la masse molaire du dioxyde de carbone ?
- Calculer la masse de de ce gaz.
- En déduire la masse volumique de dioxyde de carbone gazeux.


