
Physique et Chimie : 1ère Année Bac
Séance 8 (Suivi d'une transformation chimique)
Professeur : Mr EL GOUFIFA Jihad
Sommaire
I- Transformation chimique et réaction chimique
1-1/ Système chimique
1-2/ Transformation chimique
1-3/ Réaction chimique
II- Évolution des quantités de matière au cours d'une transformation chimique
2-1/ Avancement d'une réaction chimique
2-2/ Tableau d’avancement
2-3/ Avancement maximal et réactif limitant
2-4/ Quantités de matière en fonction de l’avancement
2-5/ Bilan de matière à l’état final
2-6/ Mélange stœchiométrique
III- Détermination de la pression d’un gaz résultant d’une réaction chimique
3-1/ Activité expérimentale
3-2/ Prévoir l’état final
IV- Exercices
4-1/ Exercice 1
4-2/ Exercice 2
4-3/ Exercice 3
4-4/ Exercice 4
I- Transformation chimique et réaction chimique
1-1/ Système chimique
Un système chimique est un ensemble d’espèces chimiques susceptibles de réagir entre elles.
Son état sera décrit en précisant :
- La nature et la quantité de matière des espèces chimiques présentes ;
- L’état physique : solide (s), liquide (l), gazeux (g), en solution aqueuse (aq)
- La température T et la pression P du système
Un système chimique peut évoluer et subir une transformation chimique qui modifie son état.
I- Transformation chimique et réaction chimique
1-2/ Transformation chimique
Un système chimique subit une transformation chimique, la nature et la quantité de matière des espèces chimiques sont différentes à l’état initial et à l’état final.
Les espèces introduites sont appelées « réactifs », et les espèces obtenues après la transformation à l’état final sont appelées « produits ».
Exemple
On verse quelques gouttes de solution de nitrate d’argent dans l’acide chlorhydrique.

I- Transformation chimique et réaction chimique
1-3/ Réaction chimique
La réaction chimique rend compte, à l’échelle macroscopique de l’évolution d’un système subissant une transformation.
- On représente la réaction chimique par une équation.
- On note à gauche la formule des réactifs et à droite la formule des produits.
- Entre les réactifs et les produits, une flèche indique le sens d'évolution du système.
Réactifs Produits
Exemple :
Au cours d’une transformation chimique il y a conservation :
- des éléments chimiques : les éléments présents dans les réactifs et les produits sont les mêmes.
- de la masse des réactifs est égale à la masse des produits.
- de la charge électrique : la somme des charges des réactifs est égale à la somme des charges des produits.
Il faut ajuster les nombres stœchiométriques pour respecter les lois de conservations.
II- Évolution des quantités de matière au cours d'une transformation chimique
2-1/ Avancement d'une réaction chimique
L'avancement d’une transformation chimique est une grandeur exprimée en mole qui permet de décrire l'état du système au cours de la transformation.
Il permet d'exprimer les quantités de matière de réactifs et de produits présents dans le système chimique à chaque instant.
L'avancement est une quantité de matière. Elle s'exprime en mol :
- Dans l'état initial :
- Au cours de la transformation :
- À l'état final :
Exemple :
Au cours de la transformation, elle consomme de et de , et elle forme de et de .
II- Évolution des quantités de matière au cours d'une transformation chimique
2-2/ Tableau d’avancement
Pour suivre l’évolution de la quantité de matière des réactifs et des produits au cours d’une transformation chimique, on construit un tableau descriptif utilisant l’avancement :
Dans un tableau d’avancement donné on doit écrire l’équation de la réaction équilibrée, puis on trace le tableau de la manière suivante :

Exemple :

II- Évolution des quantités de matière au cours d'une transformation chimique
2-3/ Avancement maximal et réactif limitant
L’état final d’un système chimique en évolution est atteint, lorsque la quantité de matière d’au moins un des réactifs devient nulle.
Le réactif qui disparaît (sa quantité de matière s’annule) est appelé réactif limitant.
L’avancement maximal est l’avancement de la réaction qui correspond à la disparition totale du réactif limitant.
Il se peut que lorsque la réaction s'arrête, tous les réactifs soient entièrement consommés. On dit qu’initialement, les réactifs étaient dans les proportions stœchiométriques.
Exemple :

Si est le réactif limitant, alors , d’où .
Si est le réactif limitant, alors , d’où .
Puisque , alors le réactif limitant est et l’avancement maximal est .
II- Évolution des quantités de matière au cours d'une transformation chimique
2-4/ Quantités de matière en fonction de l’avancement
On peut déterminer en traçant les droites représentant les variations des quantités de matière des réactifs en fonction de l’avancement x de la réaction.
Exemple :
On a : et
Les deux droites coupent l’axe horizontal et est égal à la plus petite abscisse des deux points d’intersection.
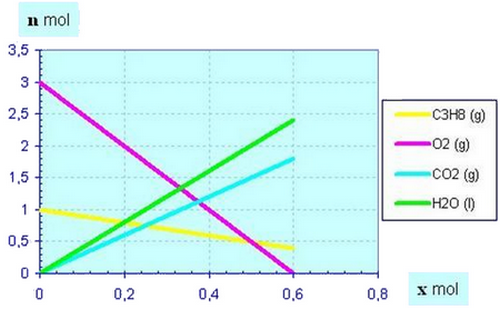
II- Évolution des quantités de matière au cours d'une transformation chimique
2-5/ Bilan de matière à l’état final
L’état final d’un système chimique en évolution est atteint lorsque la quantité de matière d’un des réactifs est nulle, celle du réactif limitant.
Exemple :

II- Évolution des quantités de matière au cours d'une transformation chimique
2-6/ Mélange stœchiométrique
Un mélange est stœchiométrique si les quantités de matière initiales sont proportionnelles aux coefficients stœchiométriques de l’équation chimique.
Dans l’état final les réactifs disparaissent complètement.
Pour la réaction suivante , le mélange est stœchiométrique si la condition suivante est vérifiée.
III- Détermination de la pression d’un gaz résultant d’une réaction chimique
3-1/ Activité expérimentale
Dans les conditions de l’expérience, à la température et sous une pression , on introduit dans un ballon de volume qui contient d’une solution d’acide chlorhydrique de concentration , un morceau de zinc de masse .
On ferme le ballon et on mesure la pression de dihydrogène formé dans le ballon.
On donne l’équation de la réaction qui se produit dans le flacon :
III- Détermination de la pression d’un gaz résultant d’une réaction chimique
3-2/ Prévoir l’état final
On peut prévoir la pression finale du gaz dihydrogène qui se produit à la fin de cette réaction par l’une des deux méthodes suivantes :
- En utilisant un appareil de mesure de la pression.
- Théoriquement en utilisant le tableau d’avancement de la réaction.
Méthode 1
Expérimentalement en mesurant la pression par un manomètre, dans l’état final, la pression est :
III- Détermination de la pression d’un gaz résultant d’une réaction chimique
3-2/ Prévoir l’état final
Méthode 2
L’utilisation des grandeurs liées aux quantités de matière permet de prévoir la pression du dihydrogène formé.
- Composition des réactifs à l’état initial
- Construction du tableau d’avancement

- Calcul de l’avancement maximal
Si le réactif limitant est , alors , et donc
Si le réactif limitant est , alors , et donc
L’avancement maximal correspond à la plus petite des deux valeurs :
- Calcul de la pression de
D’après le tableau d’avancement, la quantité de matière de dans l’état final est :
En appliquant l’équation des gaz parfait, on peut déterminer la pression de dans le ballon :
La pression finale dans le ballon est :
IV- Exercices
4-1/ Exercice 1
On verse dans un bécher d’une solution de nitrate d’argent contenant des ions argent et de concentration , et on y ajoute de poudre cuivre .
La solution initialement incolore devient bleue et il se forme un dépôt d’argent et les ions de cuivre .
- Écrire l’équation chimique modélisant la réaction.
- Décrire l’état initial du système en quantité de matière.
- Trouver le réactif limitant et calculer l’avancement maximal.
- Décrire l’état final du système en quantité de matière.
- Déterminer, à l’état final les concentrations molaires des ions en solution et les masses du (ou des) solide(s) présent(s).
Données :
IV- Exercices
4-2/ Exercice 2
Le graphe suivanté représente l’évolution, en fonction de l’avancement de la réaction , des quantités de matière des réactifs et des produits d’une réaction se produisant dans le haut fourneau :

Les réactifs sont la magnétite , le monoxyde de carbone .
Les produits sont le fer et le dioxyde de carbone.
- Écrire l’équation de cette réaction en utilisant les nombres stœchiométriques entiers les plus petits possibles.
- Comparer le nombre stœchiométrique de chaque espèce et le coefficient directeur de la droite correspondante.
- À partir du graphe déterminer l’avancement maximal de la réaction et le réactif limitant.
- À partir du graphe déterminer la composition en mol de l’état initial et de l’état final.
Données :
- Courbe (1) :
- Courbe (2) :
- Courbe(3) :
- Courbe (4) :
IV- Exercices
4-3/ Exercice 3
Le chlorate de potassium est une poudre utilisée dans les feux d'artifice pour obtenir des étincelles violettes.
Sa réaction avec du carbone donne du dioxyde de carbone et le chlorure de potassium .
- Écrire l’équation chimique de la réaction.
On réalise la transformation chimique à partir de de et de de carbone.
- Construire le tableau d’avancement et déterminer l’avancement final.
- Indiquer les quantités de chaque espèce dans le système à l’état final.
On réalise la transformation chimique à partir de de et de de carbone solides.
- Calculer les quantités de matière initiales des réactifs.
- Construire le tableau d’avancement de la réaction.
- Déterminer l’avancement maximal de la réaction.
- Calculer le volume de dioxyde de carbone gazeux obtenu dans les conditions de l’expérience.
Données :
- Volume molaire d’un gaz dans les conditions de l’expérience :
- Masses molaires atomiques :
IV- Exercices
4-4/ Exercice 4
Les ions permanganate, violets, réagissent sur des ions fer II en milieu acide pour les transformer en ions fer III.
L’équation associée est :
Aux concentrations utilisées, seuls les ions permanganates sont notablement colorés.
Dans un bécher, on introduit de solution de sulfate de fer II de concentration et d’acide sulfurique, dans lequel .
On ajoute de solution de permanganate de potassium .
Le mélange devient incolore.
- Faire le bilan des espèces présentes à l’état initial.
- Calculer les quantités de matière de celles qui participent à la réaction.
- Quelle espèce n’est plus présente à l’état final ?
- Construire le tableau d’avancement de la réaction et trouver les quantités de matière des espèces à l’état final.
- Construire un graphique représentant les variations des quantités de matières d’ions fer II et d’ions en fonction de l’avancement.


