
Physique et Chimie : 1ère Année Bac
Séance 5 (Solutions électrolytiques et concentrations)
Professeur : Mr EL GOUFIFA Jihad
Sommaire
I- Structure d'un solide ionique
1-1/ Définition
1-2/ Exemple (Chlorure de sodium)
1-3/ Formule d'un solide ionique
II- Les molécules polaires
2-1/ Définition
2-2/ Électronégativité d'un élément chimique
2-3/ Molécule du chlorure d’hydrogène
2-4/ Molécule d’eau
III- Les solutions électrolytiques
3-1/ Définition
3-2/ Étapes de la dissolution
3-3/ Dissolution d’un solide ionique dans l’eau
3-4/ Dissolution d’un liquide dans l’eau
3-5/ Dissolution d’un gaz dans l’eau
IV- Les concentrations molaires
4-1/ Concentration molaire d’une solution
4-2/ Concentration molaire d’une espèce
4-3/ Relation entre la concentration massique et la concentration molaire
V- Exercices
5-1/ Exercice 1
5-2/ Exercice 2
5-3/ Exercice 3
5-4/ Exercice 4
I- Structure d'un solide ionique
1-1/ Définition
Les corps solides ayant une forme propre difficile à déformer peuvent exister sous deux états différents :
État désordonné caractérisé par une structure non ordonnée comme le verre et le caoutchouc.
État ordonné caractérisé par une structure cristalline ordonnée comme les composés ioniques.
Les solides ioniques cristallins sont électriquement neutres, ils ont une structure constituée par un arrangement ordonné dans l’espace d’ions chargés positivement (ou cations) et d’ions chargés négativement (ou anions).
La cohésion du solide ionique est assurée par les interactions électriques des anions et des cations qui le constituent.
I- Structure d'un solide ionique
1-2/ Exemple (Chlorure de sodium)
Le chlorure de sodium est composé d’un assemblage d’un ion sodium et d’un ion chlorure .
La formule statistique de chlorure de sodium est alors .
Le chlorure de sodium a une structure cristalline cubique constituée d’un assemblage d’ions sodium et d’ions régulièrement disposés dans l’espace.

La cohésion du cristal ionique est due aux forces d’interactions électriques : les forces d’attraction électriques entre les ions de signes opposés l’emportent sur les forces de répulsions entre les ions de même signe.
I- Structure d'un solide ionique
1-3/ Formule d'un solide ionique
Tout solide ionique est repéré par un nom et une formule chimique qui dépendent tous les deux des ions qui le composent.
Ainsi la formule chimique d’un solide ionique indique la nature et la proportion des ions présents de façon à respecter l’électro-neutralité sans en mentionner les charges.
Exemples
| Nom du composé ionique | Sa formule statistique | Sa formule ionique |
| Chlorure de sodium | ||
| Chlorure d’aluminium |
II- Les molécules polaires
2-1/ Définition
Généralement les molécules diatomiques constituées de deux atomes différents sont polaires, car le doublet électronique commun est attiré vers l’atome le plus électronégatif.
Une molécule est un ensemble d'atomes (au moins deux) identiques ou non, unis les uns aux autres par le biais de liaisons chimiques.
Ces dernières sont les résultats de la mise en commun d'un certain nombre d'électrons gravitant sur la couche externe des atomes.
La liaison est dite covalente simple lorsque deux atomes mettent en commun un unique électron de leur couche externe chacun.
II- Les molécules polaires
2-2/ Électronégativité d'un élément chimique
L'électronégativité d'un élément traduit la tendance d'un atome de cet élément à attirer le doublet d’électrons d'une liaison covalent qu'il forme avec un autre atome.
Plus un élément est électronégatif, plus il attire à lui le doublet d'électrons de la liaison covalent.
L’électronégativité varie selon la place de l’élément dans la classification périodique :
- Sur une même ligne, l’électronégativité augmente de gauche à droite.
- Dans une même colonne , elle augmente de bas en haut.
Les alcalins ont tendance à perdre des électrons, alors que les halogènes ont tendance à gagner des électrons. Ainsi, ils peuvent acquérir la structure des gaz nobles.
II- Les molécules polaires
2-3/ Molécule du chlorure d’hydrogène
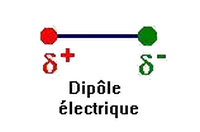
Dans la molécule de chlorure d’hydrogène , l’atome de chlore et l’atome d’hydrogène mettent en commun un doublet d’électrons constituant ainsi une liaison covalente.
Le chlore est plus électronégatif que l’hydrogène, le doublet électronique est proche de l’atome de chlore que de celui d’hydrogène, ce qui provoque l’apparition d’une charge partielle négative sur l’atome de chlore et d’une charge partielle positive sur l’atome d’hydrogène.

La liaison est dite polarisée.
La molécule a un caractère dipolaire, elle constitue un dipôle électrique.
II- Les molécules polaires
2-4/ Molécule d’eau
L’oxygène est plus électronégatif que l’hydrogène.
Les deux liaisons covalentes O-H d’une molécule d’eau sont donc polarisées.
Il en résulte l’apparition de charges partielles sur l’atome d’oxygène et d’une charge partielle sur chaque atome d’hydrogène.

Du point de vue de la répartition des charges, les deux charges partielles sont équivalentes à une charge unique située au point K situé au milieu du segment HH’, c’est le barycentre des charges positives.

Comme le barycentre des charges positives ne coïncide pas avec le barycentre des charges négatives, la molécule d’eau présente un caractère dipolaire. On dit qu’elle est polaire.
III- Les solutions électrolytiques
3-1/ Définition
Une solution électrolytique est obtenue en dissolvant une substance appelée soluté dans un liquide appelé
solvant.
Le soluté peut être un solide, un liquide ou un gaz.
Si le solvant est l'eau la solution obtenue est appelée solution aqueuse.
Une solution électrolytique est une solution contenant des ions, elle conduit le courant et elle est électriquement neutre.
Le solvant est présent en grande quantité par rapport au soluté.
Lorsque le soluté introduit est totalement dissout, on dit que la solution est non saturée, sinon, on dit quelle est saturée.
Exemple
Une solution de chlorure de sodium est notée :
III- Les solutions électrolytiques
3-2/ Étapes de la dissolution
La dissolution d’un composé ionique comprend trois étapes :
Une dissociation
Les forces électrostatiques qui s’exercent entre le solvant et les ions à la surface du cristal compensent les forces électrostatiques attractives internes du cristal sur ces ions : les ions se détachent du cristal.

Une solvatation
Les ions dissociés s’entourent de molécules de solvant attirées sous l’effet des forces électrostatiques. Les ions sont solvatés.
Si le solvant est de l’eau, on ajoute l’indice (aq) en indice à la formule de l’ion.

Une dispersion
Sous l’effet de l’agitation thermique (ou par une agitation mécanique réalisée par un agent extérieur), les ions solvatés se répartissent progressivement dans l’ensemble du solvant. On obtient un mélange homogène : la solution.
III- Les solutions électrolytiques
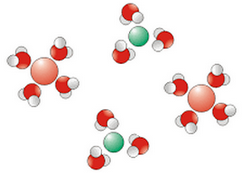
3-3/ Dissolution d’un solide ionique dans l’eau
Lorsqu’on ajoute du chlorure de sodium à l’eau, celle-ci devient plus conductrice du courant électrique.
On dit que la solution obtenue est électrolytique.
Les molécules d’eau grâce à leur caractère polaire entrent en interaction avec les ions du cristal, elles affaiblissent puis rompent les liaisons ioniques.
Les ions se dispersent dans l’eau et s’entourent de molécules d’eau, on dit qu'ils s’hydratent.

L’équation de la réaction de la dissolution du chlorure de sodium dans l’eau s’écrit :
III- Les solutions électrolytiques
3-4/ Dissolution d’un liquide dans l’eau
L’acide sulfurique pur est un liquide, sa formule est .
Lors de la dissolution de l’acide sulfurique , il se produit une transformation chimique due à une interaction entre les molécules d’acide sulfurique et d’eau.
Ces deux types de molécules sont polaires. L’acide sulfurique se dissocie en ions hydrogène et ions sulfates .
L’équation de la réaction de la dissolution de l’acide sulfurique dans l’eau s’écrit :
III- Les solutions électrolytiques
3-5/ Dissolution d’un gaz dans l’eau
Le chlorure d’hydrogène est un gaz à pression et température ordinaire qui se dissout très facilement dans l’eau (expérience du jet d’eau) :

Lors de la dissolution, il se produit une transformation chimique due à une interaction entre les molécules de chlorure d’hydrogène et d’eau, toutes les deux polaires.
Les liaisons intermoléculaires affaiblissent la liaison covalente pour se casser et conduisent ainsi à l’apparition des ions solvatés et .
L’équation de la réaction de la dissolution du chlorure d’hydrogène dans l’eau s’écrit :
IV- Les concentrations molaires
4-1/ Concentration molaire d’une solution
La concentration molaire d’une solution en , est la quantité de matière de soluté dissoute par litre de solution :
IV- Les concentrations molaires
4-2/ Concentration molaire d’une espèce
Si une espèce est effectivement présente en solution, la concentration de cette espèce est la quantité de matière de cette espèce présente par litre de solution :
La notation ne peut étre utilisée que pour une espèce réellement présente en solution.
L’écriture n’a pas de sens car l’espèce n’existe pas en solution, il est totalement détruit par l’eau.
IV- Les concentrations molaires
4-3/ Relation entre la concentration massique et la concentration molaire
On a :
Donc :
V- Exercices
5-1/ Exercice 1
On fait dissoudre de sulfate d'aluminium (composé ionique) dans d'eau.
- Écrire l'équation de dissolution.
- Calculer la concentration de soluté apporté.
- Calculer la concentration molaire de chaque espèce d'ions dans la solution.
Données :
V- Exercices
5-2/ Exercice 2
On veut préparer 100mL d’une solution de chlorure de fer (III) (Fe3+ +3Cl-) telle que la concentration molaire effective en ions chlorure soit
- Écrire la formule du chlorure fer (III).
- Écrire l’équation de la réaction de dissolution du chlorure de fer (III) dans l’eau.
- Quelle est la concentration molaire apportée en chlorure de fer (III) ?
- Quelle masse de chlorure de fer (III) doit-on peser pour préparer la solution désirée ?
M(Cl)= 35.5 g/mol M(Fe)= 56 g/mol
V- Exercices
5-3/ Exercice 3
Dans la chimie, le terme « potasse » peut englober les solides ioniques suivant : le chlorure de potassium et le chlorure de magnésium , utilisés pour fabriquer des savons mous et des engrais.
- Écrire les équations de dissolution dans l’eau des deux solides ioniques et .
On mélange un volume d’une solution aqueuse de chlorure de potassium de concentration avec un volume d’une solution aqueuse de chlorure de magnésium de concentration .
- Calculer les concentrations molaires effectives des ions dissouts dans la solution finale.
V- Exercices
5-4/ Exercice 4
L’acide sulfurique est l’acide le plus employé dans l’industrie, c’est un liquide visqueux très soluble dans l’eau.
- Vérifier que la concentration d’une solution commerciale concentrée d'acide sulfurique à , et qui présente une densité vaut .
2)Quel est le volume de solution commerciale à prélever afin de préparer d'acide sulfurique de concentration ?
- Détailler les principales étapes de cette dilution (on pourra s’aider de schémas).
- Écrire l’équation de dissolution de l’acide sulfurique et en déduire les concentrations effectives en espèces ioniques de la solution-fille précédente.
L’étiquette d’une solution saturée commerciale d’acide chlorhydrique est la suivante :

Les données sont valables à 20 °C.
- Que veut dire solution saturée ?
- Quelle est la concentration en soluté apporté ?
- En déduire la solubilité du chlorure d’hydrogène gazeux dans l’eau : c’est la masse maximale de chlorure d’hydrogène gazeux qu’on peut dissoudre par litre de solution.
- La molécule de chlorure d’hydrogène est-elle dipolaire ? Justifier sa bonne solubilité dans l’eau.
- Rigoureusement, quelle devrait être la formule de l’acide chlorhydrique ?
Données :
- Électronégativité croissante :
- M(H2SO4)=98g/mol


