
Physique et Chimie : Tronc Commun
Séance 4 (Extraction, séparation et identification des espèces chimiques)
Professeur : Mr EL GOUFIFA Jihad
Sommaire
I- L'extraction d’espèces chimiques
1-1/ Historique
1-2/ Extraction par solvant organique
1-3/ Extraction par hydrodistillation (Distillation simple)
1-4/ Distillation fractionnée
II- Chromatographie sur couche mince (C.C.M)
2-1/ Principe
2-2/ Réalisation d'une CCM
2-3/ Révélation du chromatogramme
2-4/ Exploitation de chromatogramme
III- Caractéristiques physiques d’une espèce chimique
IV- Exercices
4-1/ Exercice 1
4-2/ Exercice 2
4-3/ Exercice 3
4-4/ Exercice 4
I- L'extraction d’espèces chimiques
1-1/ Historique
Depuis l’antiquité, l’homme utilise les végétaux pour extraire des colorants, des parfums, des médicaments, tout en utilisant des méthodes traditionnelles comme :
L’expression (ou pressage) : Cette opération consiste à « faire sortir » un produit en exerçant une pression.
- Exemple : pressage d’olive pour obtenir de l’huile.
La décantation (solide/liquide) et (liquide/liquide) : On sépare des espèces chimiques non miscibles, de densités différentes.
- Exemple : eau boueuse et cas des liquides non miscibles
La filtration : On sépare les constituants d’un mélange solide-liquide
L'enfleurage : C'est une extraction d'espèces aromatiques préféré pour les plantes fragiles. On les dépose sur des graisses inodores, (solide ou liquide, froide ou chaude) puis on récupère les arômes par malaxage des graisses avec de l’alcool.
La macération : Elle consiste à mettre une plante dans un solvant généralement froid pendant quelques heures à quelques semaines pour récupérer les arômes et les espèces colorées.
L'infusion : Elle consiste à verser un liquide chaud sur la plante hachée.
- Exemple : Un thé est préparé par infusion dans l'eau chaude des feuilles de théier séchées. La technique est similaire pour le café.
La décoction : On place les plantes dans de l’eau froide ; le tout est porté en ébullition est les constituants se dissolvent dans l’eau. Cette méthode est très ancienne.
Toutes ces techniques connues depuis longtemps ont été perfectionnées et sont toujours utilisées.
I- L'extraction d’espèces chimiques
1-2/ Extraction par solvant organique
Principe
L’extraction par un solvant (ou extraction liquide –liquide) permet d’extraire une espèce chimique dissoute dans un solvant, à l’aide d’un autre solvant, appelé solvant extracteur.
Choix du solvant extracteur
L’extraction par un solvant consiste à dissoudre l’espèce chimique recherchée dans un solvant non miscible avec l’eau et à séparer les deux phases obtenues.
En plus l’espèce chimique à extraire doit être plus soluble dans le solvant à extracteur que dans l’eau, ce qui permet de les séparer en utilisant une ampoule à décanter.
I- L'extraction d’espèces chimiques
1-2/ Extraction par solvant organique
Exemple : Extraction du diiode présent dans une solution
On introduit le mélange d’une solution aqueuse d’iodure de potassium et de diiode dans l’ampoule à décanter :
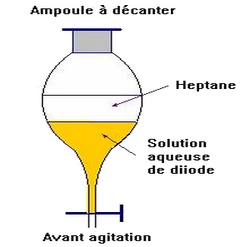
On ajoute le solvant (heptane), on agite et on laisse décanter et dégazer le mélange.
On observe deux phase (figure 4) :
- La phase inférieure qui est pratiquement décolorée.
- La phase supérieure qui contient le diiode dans le solvant de coloration violette.
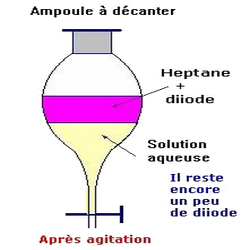
On récupère le diiode et le solvant.
Après évaporation du solvant, on recueille le diiode (solide).
I- L'extraction d’espèces chimiques
1-2/ Extraction par solvant organique
Conclusion
L’extraction par un solvant consiste à dissoudre l’espèce chimique recherchée dans un solvant non miscible avec l’eau et à séparer les deux phases obtenues.
L’extraction par un solvant se réalise dans une ampoule à décanter.
Le choix du solvant dépend de l’espèce chimique recherchée.
L’espèce chimique doit être plus soluble dans le solvant que dans l’eau.
I- L'extraction d’espèces chimiques
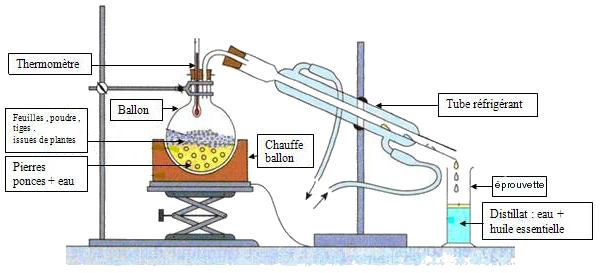
1-3/ Extraction par hydrodistillation (Distillation simple)
Principe
La technique consiste à faire bouillir un mélange d’eau et du produit à extraire, puis on le condense dans un réfrigérant.
Il s’agit de la distillation d’un mélange d’eau et d’un produit naturel.
Lorsque l’on chauffe ce mélange, les arômes et les odeurs du produit (huile essentielle) naturel sont entraînés par la vapeur d’eau.
Il suffit alors de condenser les vapeurs qui se dégagent par un réfrigérant afin de récupérer les arômes.
Le liquide que l’on obtient est appelé distillat qui comporte deux phases :
- Une phase aqueuse qui est de l’eau
- Une phase organique qui consiste de l’huile essentielle
I- L'extraction d’espèces chimiques
1-3/ Extraction par hydrodistillation (Distillation simple)
Exemple : Extraction de l’huile essentielle de lavande
- Peser 10g de fleurs de lavande et les introduire dans le ballon
- Ajouter 100 mL d’eau distillé à l’aide d’une éprouvette graduée et mettre l’agitateur magnétique.
- Réaliser le montage d’hydrodistillation puis mettre en route la circulation d’eau dans le réfrigérant.
- Porter le mélange à ébullition.
- Arrêter le chauffage après l’obtention d’environ 50 ou 60 mL de distillat dans l’erlenmeyer.
- Effectuer une décantation dans une ampoule à décanter pour séparer l’huile de l’eau de fleur.
I- L'extraction d’espèces chimiques
1-4/ Distillation fractionnée
Elle permet de séparer les espèces chimiques constituant un mélange liquide.
Le mélange à distiller est placé dans un ballon surmonté d’une colonne à distiller : colonne de Vigreux.
On chauffe le ballon jusqu’à ébullition du mélange. Les vapeurs des différentes espèces chimiques montent dans la colonne à distiller.
La colonne à distiller permet de séparer les différentes espèces chimiques. En tête de colonne à distiller, on trouve l’espèce chimique la plus volatile. Les autres se condensent et retombent dans le ballon.
L’espèce chimique la plus volatile est condensée grâce au réfrigérant.
On recueille le distillat.

II- Chromatographie sur couche mince (C.C.M)
2-1/ Principe
La chromatographie est un procédé de séparation et d’identification d’espèces chimiques présentes dans un mélange par différence d’affinité à l’égard de deux phases:
- L’une fixe appelée phase stationnaire, couche de gel de silice déposée sur une plaque d’aluminium ou plastique
- L’autre mobile appelée phase mobile ou éluant.: C’est le solvant dans lequel les constituants du mélange sont plus ou moins solubles.
L’éluant migre le long de la phase fixe grâce au phénomène de capillarité. Il entraîne les constituants du mélange qui se déplacent à des vitesses différentes. On peut ainsi les séparer.

II- Chromatographie sur couche mince (C.C.M)
2-1/ Réalisation d'une CCM
La CCM se déroule en 4 étapes : préparation de la cuve, préparation de la plaque et élution .
- Préparation de la cuve
Un cuve de chromatographie se compose de la cuve et d'un couvercle. En placer l'éluant la cuve puis fermer le couvercle.
- Préparation de la plaque
Tracer au crayon un trait à 1 cm du bas de la plaque.
Sur ce trait tracer les petits points à 1 cm de distance où seront déposés les taches.
Déposer à l'aide d'une micropipette (ou pipette Pasteur) les solutions sur chaque point.
- Élution
Placer la plaque dans la cuve, fermer et laisser l'éluant diffuser.
Arrêter la CCM lorsque le front d'éluant est arrivé à 1 cm du haut de la plaque
Sortir la plaque et tracer au crayon le front de l'éluant puis sécher la plaque.

II- Chromatographie sur couche mince (C.C.M)
2-3/ Révélation du chromatogramme
Le résultat de la chromatographie s’appelle le chromatogramme.
Dans le cas des composés colorés, le chromatogramme est directement exploitable.
Dans le cas de composés incolores, il est nécessaire de faire apparaître les taches : c’est l’étape de révélation.
On peut pour cela utiliser une lampe à ultraviolet ou les cristaux d’iode.
- Révélation UV : Placer la plaque sous une lampe UV et entourer les taches colorés.
- Révélation à l'iode : Dans un flacon, placer la plaque et quelques cristaux d'iodes, puis boucher. Les taches apparaissent.

II- Chromatographie sur couche mince (C.C.M)
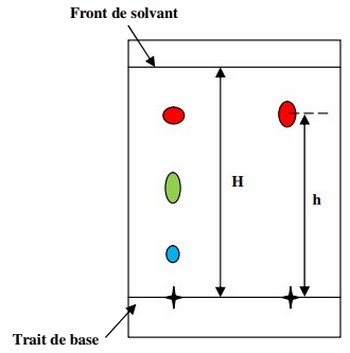
2-4/ Exploitation de chromatogramme
On mesure la hauteur parcourue par le solvant et la hauteur atteinte par chaque tâche.
Le rapport frontal, noté , est caractéristique d’un produit dans un éluant donné et pour une phase stationnaire donnée :
Analyse de chromatogramme :
- Chaque tâche dans le chromatogramme correspond une seule espèce chimique.
- Si l’échantillon à analyser est séparé à plusieurs taches, on dit qu’il contient d’espèces chimiques différentes.
- Deux tâches ou plus présentant le même rapport frontal ou la même hauteur par rapport à la ligne de dépôt (de base) sur la même plaque sont identiques.
III- Caractéristiques physiques d’une espèce chimique
Chaque espèce chimique possède des caractéristiques physiques qui lui sont propres :
- Températures de changement d’état
La température d’ébullition est la température à laquelle s’effectue le passage de l’état liquide à l’état gazeux d’une espèce.
La température de fusion est la température à laquelle s’effectue le passage de l’état solide à l’état liquide d’une espèce.
- Densité
La densité d’un corps solide ou liquide par rapport à l’eau est le rapport de la masse d’un certain volume du corps par la masse du même volume d’eau : .
- : masse volumique du corps ;
- : masse volumique de l’eau.
C’est une grandeur sans unité.
- Solubilité
Elle exprime la masse d’une substance que l’on peut dissoudre dans un litre d’un solvant donné.
Elle s’exprime en général en .
IV- Exercices
4-1/ Exercice 1
On désire extraire le diiode de l'eau iodée.
La solubilité du diiode dans différents solvants est donnée dans le tableau suivant :

On dispose en outre des informations suivantes :
- L'alcool est miscible à l'eau.
- L'éther et le benzène ne sont pas miscibles à l'eau.
- Rechercher la définition du mot solubilité.
- Quel solvant vaut-il mieux choisir pour extraire le diiode de l'eau iodée? Justifier la réponse.
- Dresser le protocole de cette extraction (verrerie à utiliser, mode opératoire)
- Quelle phase faut-il recueillir ? Où se trouve t-elle ?
IV- Exercices
4-2/ Exercice 2
L’extraction de l’huile essentielle de lavande s’effectue à l’aide d’un montage à l’entraînement à la vapeur (ou hydrodistillation) :
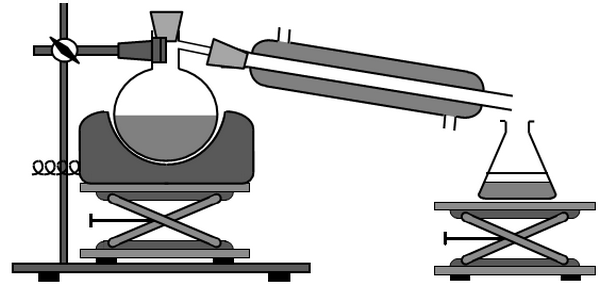
- Compléter ce schéma en utilisant les termes suivants :
Chauffe-ballon - Ballon à fond rond - Support - Distillat - Réfrigérant à eau - Arrivée d’eau froide - Sortie d’eau tiède - Support élévateur - Erlenmeyer - Phase supérieure - Phase inférieure.
- Quel est le rôle de la vapeur d’eau ? Celui du réfrigérant à eau ?
- Représenter le contenu de l’erlenmeyer après l’hydrodistillation. Justifier.
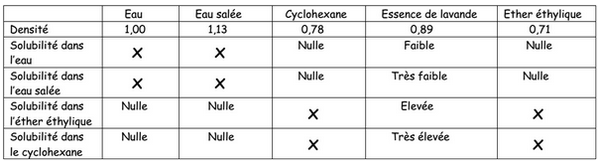
Afin de récupérer l’huile essentielle du distillat, on effectue une extraction par solvant.
On introduit dans une ampoule à décanter le distillat, d’eau salée et du solvant extracteur.
On bouche, on agite, on dégaze et on laisse décanter.
- Quel est l’intérêt d’ajouter de l’eau salée ?
- A l’aide des données du tableau ci-dessous, quel solvant extracteur peut-on choisir ? Justifier.
- Représenter l’ampoule à décanter après décantation. Légender en justifiant.
IV- Exercices
4-3/ Exercice 3
Le benzaldéhyde est une molécule à l'odeur caractéristique d'amande amère et on sait la synthétiser au laboratoire; c'est pourquoi, à défaut d'extrait d'amande amère, plus coûteux, il est souvent utilisé pour parfumer les pâtisseries et certaines boissons comme le sirop d'orgeat.
On veut vérifier la composition d’une essence naturelle d’amande amère et d’une boisson à l’aide d’une chromatographie sur couche mince.
On prépare la plaque et on y dépose des micro-gouttes de :
- benzaldéhyde commercial (B)
- essence d'amande amère naturelle (A.A)
- extrait de la boisson étudiée (Boisson)
Analyse du chromatogramme

- L'extrait naturel d'amande amère (A.A) est-il constitué uniquement de benzaldéhyde (B) ?
- La boisson étudiée est-elle parfumée à l'arôme de synthèse ou à l'extrait naturel ?
- Contient-elle d'autres substances révélées par le chromatogramme ?
Questions techniques
- Quel est le nom du liquide dans lequel on a trempé la plaque
- Comment définit-on le rapport frontal Rf ? le calculer pour le benzaldéhyde.
- Pourquoi y a t-il des taches à différentes hauteur ?
IV- Exercices
4-4/ Exercice 4
On cherche à identifier l’espèce chimique active d’un médicament (noté X). Pour cela, on réalise une chromatographie sur couche mince.
Les références sont : l’aspirine (notée A), l’acétaminophène (B), la caféine (C) et la phénacétine (D).
La plaque chromatographique a les dimensions suivantes : largeur = 4,5cm ; hauteur = 5cm
Les dépôt sont effectués à 0,5 cm du bord inférieur.
Après élution et révélation, les résultats suivants sont obtenus :
- Le front de l’éluant est monté à 0,5 cm du bord supérieur.
- Pour les références, on trouve :
| Espèce chimique | Aspirine | Acétaminophène | Caféine | Phénacétine |
| 0,85 | 0,50 | 0,31 | 0,72 |
Pour X, on trouve 3 tâches dont les sont respectivement à 0,13 ; 0,50 et 0,86.
- Faire un schéma du chromatogramme après élution à l’échelle 1/1. Les positions des taches devront être justifiées.
- On dit que la chromatographie est une technique de séparation et d’identification. Expliquer en quelques lignes comment on peut identifier des espèces chimiques grâce à la chromatographie.
- De quels paramètres dépendent les valeurs des rapports frontaux ?
- Faire une conclusion sur X.


