
Physique et Chimie : 1ère Année Bac SM
Séance 10 (Travail et énergie interne)
Professeur : Mr EL GOUFIFA Jihad
Sommaire
I- Effets du travail d'une force
II- Énergie interne d'un système
2-1/ Définition
2-2/ Énergies cinétiques microscopiques
2-3/ Énergies potentielles microscopiques
III- Échange d’énergie au cours d’une transformation
3-1/ Échange d’énergie
3-2/ Variation de l’énergie d’un système
IV- Premier principe de la thermodynamique
4-1/ Énoncé
4-2/ Conséquences
V- Exercices
5-1/ Exercice 1
5-2/ Exercice 2
5-3/ Exercice 3
5-4/ Exercice 4
I- Effets du travail d'une force
Le travail reçu par un corps peut :
Le déformer (objet élastique)
- Exemple : lorsqu'on tend un arc, il se déforme ce qui modifie les interactions microscopiques entre les particules qui constituent l'arc.
Cette déformation de l'arc entraîne une mise en réserve d'énergie qui pourra être cédée à la flèche.
Élever sa température
- Exemple : forces de frottement d'un frein sur une roue de vélo.
L'augmentation de la température traduit une plus grande agitation microscopique (donc une augmentation de l'énergie cinétique microscopique).
Le faire changer d'état
- Exemple : Le travail des forces de frottement des skis sur la neige entraîne la fusion de la neige, donc une modification des interactions microscopiques.
Cette énergie microscopique d'origine cinétique et potentielle est appelée énergie interne du système, notée U
II- Énergie interne d'un système
2-1/ Définition
Chaque système matériel possède une énergie que l'on peut décomposer sous deux formes :
L'énergie mécanique d'un système est définie comme la somme de son énergie cinétique et son énergie potentielle. Ces deux formes d énergie sont macroscopiques
L'énergie interne, notée U, est une forme d'énergie microscopique.
L’énergie interne U concerne l’agitation thermique des particules qui constituent le système.
- Pour les solides : l’agitation se traduit par des vibrations des atomes au sein de la matière qui se
- transmettent de proche en proche.
- Pour les liquides : l’agitation se traduit par les mouvements des molécules les unes par rapport aux autres.
- Pour les gaz : l’agitation se traduit par des vibrations des molécules autour des positions d'équilibre.
II- Énergie interne d'un système
2-2/ Énergies cinétiques microscopiques
Les énergies cinétiques correspondent au mouvement du système dans son ensemble ainsi qu’aux mouvements des particules qui le constituent, dus à l'agitation thermique des particules.
II- Énergie interne d'un système
2-3/ Énergies potentielles microscopiques
Les énergies potentielles dues aux interactions du système avec le milieu extérieur par l’intermédiaire de champs gravitationnel, électriques ou magnétiques, mais aussi dues aux interactions entre les molécules, ions, atomes, électrons, noyaux, nucléons… qui constituent ce système.
III- Échange d’énergie au cours d’une transformation
3-1/ Échange d’énergie
L’énergie peut s’échanger avec le milieu extérieur de deux manières différentes :
- Soit par un travail (qui peut être fourni ou reçu par le système).
- Soit par échange de chaleur (qui peut être reçue ou perdue le système).
Échange d’énergie sous forme de travail de forces d’opérateur extérieur
Un gaz est enfermé dans un récipient (cylindre) dont l’une (piston) des parois solides est mobile.
Un opérateur extérieur en exerçant une force sur le piston provoque le déplacement de ce dernier et, par exemple, une diminution du volume occupé par le gaz.
Il se produira une augmentation de la pression du gaz et, généralement, une variation de la température du gaz (une augmentation de l’agitation de ses atomes) .
Le travail fournit par l’opérateur pour comprimer le gaz permet de transférer une énergie qui sera stockée dans le gaz.
III- Échange d’énergie au cours d’une transformation
3-1/ Échange d’énergie
Transferts thermiques (ou transfert de chaleur ou transfert d’énergie calorifique)
Lorsque nous mettons en contact des corps de températures différentes, nous produisons une modification de l’état de ces corps (changement des températures et/ou de phases).
L’eau contenue dans une casserole en contact avec la flamme d’un gaz en combustion voit sa température s’élever, puis elle se met à bouillir c’est à dire elle se transforme en vapeur (gaz).
Nous ne pouvons attribuer ces modifications de l’état du système à des échanges d’énergie.
Dans ce cas, nous parlons de transferts thermiques (ou de transfert de chaleur).
III- Échange d’énergie au cours d’une transformation
3-2/ Variation de l’énergie d’un système
La variation d’énergie interne d’un système résulte d’un échange d’énergie avec le milieu extérieur soit par un travail , ou par un transfert de chaleur : .
S'il n'y a aucun échange de chaleur , et donc . Dans ce cas, la variation d'énergie interne du système est égale au travail reçu ou fourni par le système.
Si aucun travail n'est reçu ou fourni par le système , et donc . Dans ce cas, la variation d'énergie interne du système est égale à la quantité de chaleur échangée.
IV- Premier principe de la thermodynamique
4-1/ Énoncé
Au cours d’une transformation, la variation d’énergie interne est égale à l’énergie totale échangée avec l’extérieur :
le travail et la chaleur sont positifs s'ils sont reçus par le système et négatifs s'ils sont cédés par le système.
IV- Premier principe de la thermodynamique
4-2/ Conséquences
Énergie d’un système isolé
Si le système est isolé, il n’y a pas d’échange d’énergie entre le système et le milieu extérieur : , ou encore .
L’énergie d’un système isolé est constante
Énergie d’une transformation cyclique
Si une transformation amène un système d’un état initial à un état final identique, la transformation est cyclique, donc :
V- Exercices
5-1/ Exercice 1
On considère un chariot de masse pouvant glisser sur deux rails orientés selon la plus grande pente d’un plan incliné.
On lance le chariot d’un point A situé dans le plan horizontal, avec une vitesse initiale , il atteint un point C situé à la hauteur du plan horizontal.
On prendra .
- Calculer la variation de l’énergie mécanique au cours de ce mouvement.
- En déduire la quantité de chaleur échangée Q avec le milieu extérieur.
V- Exercices
5-2/ Exercice 2
On dispose d’un cylindre adiabatique fermé par un piston notamment adiabatique de masse et de section pouvant se déplacer verticalement sans frottement.
Le cylindre contient un volume d’air à la température .
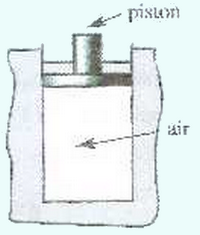
- Sachant que la pression externe est , calculer la pression de l’air contenu dans le cylindre.
On place sur le piston un solide de masse .
Le piston se stabilise dans une nouvelle position, et la température à l’intérieur du cylindre est supposée invariante.
- Calculer la nouvelle pression de l’air contenu dans le cylindre.
- Calculer le travail de la force exercée sur l’air comprimé sachant que le piston s’est déplacé de .
L’air contenu dans le cylindre est supposé un gaz parfait dans les conditions de l’expérience, sa température est considérée inchangée.
- Que peut-on dire de l’énergie interne de l’air contenu dans le cylindre ?
On prend :
V- Exercices
5-3/ Exercice 3
La machine à vapeur constitue un exemple de machines thermique dans laquelle le fluide thermique (l’eau) décrit une transformation cyclique en prélevant une centaine quantité de chaleur de la source chaude (La chaudière) qui le transforme en vapeur, et en restituant une certaine quantité de chaleur à la source froide (le condenseur) où la vapeur est condensée en eau liquide.
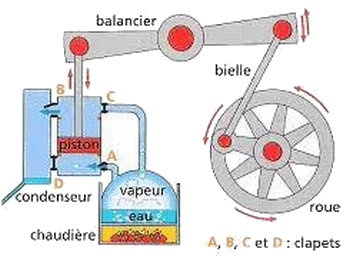
- Quel est le signe de , et quel est le signe de ?
- Quelle est la variation de l’énergie interne du fluide à la fin du cycle ?
- Sachant que et , calculer le travail W réalisé par le fluide thermique pendant un cycle.
- Sachant que cette machine accomplit 2800 cycles par minute, calculer sa puissance .
On définit le rendement
- Déterminer le rendement de cette machine. Conclure.
V- Exercices
5-4/ Exercice 4
On dispose de deux palets autoporteurs identiques, de masse chacun, et d’un ressort de raideur .
Les deux palets sont posés sur un plan horizontal. Il n’y a pas de frottement. Le ressort est comprimé entre les deux palets d’une longueur , l’ensemble étant maintenu par un fil tendu.
Le dispositif étant immobile, on coupe le fil, et le ressort se détend.
Lorsque le contact est rompu entre les deux palets et le ressort, les palets sont en translation : leurs vecteurs vitesses sont opposés et ont même valeur .
Le système est l’ensemble {ressort + 2 palets}.
On prend le plan horizontal passant par le le centre gravité des deux palets comme état de référence de l'énergie potentielle de pesanteur
L’énergie interne d’un ressort comprimé d’une longueur est égale à .
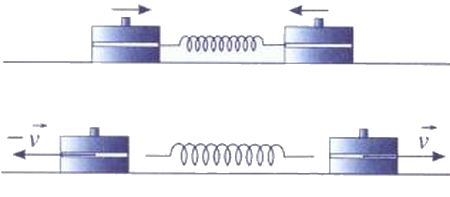
- Exprimer l’énergie du système lorsque le ressort est comprimé.
- Exprimer son énergie lorsque le ressort a repris sa longueur au repos.
- Déterminer la variation de l’énergie interne du ressort.
- Calculer .


