
Physique et Chimie : 2ème Année Bac SVT-STE-STM
Semestre 1 Devoir 2 Modèle 1
Professeur : Mr El GOUFIFA Jihad
Exercice 1 (7 pts)
Pour déterminer la capacité d’un condensateur, on réalise le montage de la figure 1 qui est formé des éléments suivants :
- Un générateur idéal de tension de force électromotrice .
- Un conducteur ohmique de résistance .
- Un condensateur déchargé de capacité et un interrupteur et des fils de connexion .
À l’instant , on ferme l’interrupteur et on suit par un dispositif convenable les variations de la tension appliquée aux bornes du condensateur en fonction du temps et on obtient la figure 2 :
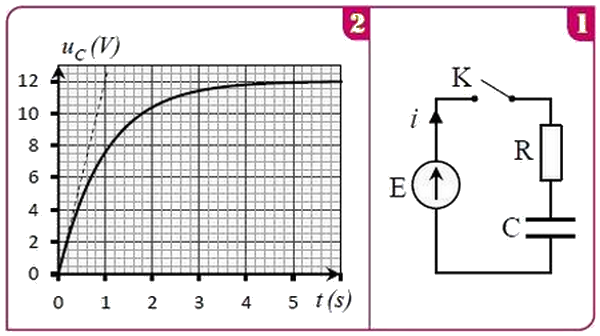
- Représenter sur la figure 1 dans la convention récepteur les tensions et .
- Montrer que l’équation différentielle vérifié par la tension aux bornes du condensateur est :
- Trouver les expressions de et pour que l’expression soit solution de l’équation différentielle.
- Par l’analyse dimensionnelle montrer que a une dimension du temps.
- Trouver graphiquement et montrer que .
- Calculer l’énergie électrique stockée dans le condensateur dans le régime permanent.
Exercice 2 (6 pts)
L'air contient du Radon en quantité plus ou moins importante. Ce gaz radioactif naturel est issu des roches contenant de l'uranium et du radium.
Le radon se forme par désintégration du radium (lui-même issu de la famille radioactive de l'uranium ), selon l'équation de réaction nucléaire suivante :
- Quel est le type de radioactivité correspondant à cette réaction de désintégration ? Justifier votre réponse.
- Donner l'expression littérale du défaut de masse du noyau de symbole et de masse .
- Calculer le défaut de masse du noyau de radium . L'exprimer en unité de masse atomique .
- Écrire la relation d'équivalence masse-énergie.
Le défaut de masse du noyau de radon vaut
- Définir l'énergie de liaison d'un noyau.
- Calculer, en joule, l'énergie de liaison du noyau de radon.
- Vérifier que cette énergie de liaison vaut .
- En déduire l'énergie de liaison par nucléon du noyau de radon.
- Exprimer ce résultat en .
- Établir littéralement la variation d'énergie de la réaction (1) en fonction de , et , masses respectives des noyaux de radium, de radon et d'hélium.
- Exprimer en joule.
Données :
- et
- Masse d’un proton :
- Masse d’un neutron :
- Célérité de la lumière dans le vide :
- Masse du noyau Radium 226 :
- Masse du noyau Radon 222 :
- Masse du noyau Helium 4 :
Exercice 3 (7 pts)
- Définir un acide selon Bronsted.
- Écrire l’équation de la dissociation d’un acide dans l’eau en précisant les couples acide/base qui participent dans cette réaction
- Écrire l’équation de la réaction d’une base avec de l’eau en précisant les couples acide/base qui participent dans cette réaction
On se propose d’étudier si deux solutions d’acides différents, mais de même concentration.
On dispose d’une solution de chlorure d’hydrogène (acide chlorhydrique ) et d’une solution d’acide éthanoïque () de même concentration en soluté apporté .
La mesure de donne pour et pour .
- Quel est l’outil utilisé pour mesurer le dans ce cas ? justifier votre réponse.
- Déterminer la concentration des ions oxonium dans chacune des solutions.
On s’intéresse maintenant à la détermination du taux d’avancement.
- En considérant un volume de solution aqueuse d’un acide , de concentration molaire en soluté apporté , dresser le tableau d’avancement de la réaction de l’acide avec l’eau en le complétant avec les valeurs littérales de la concentration , du volume , de l’avancement au cours de transformation et de l’avancement final .
- Déterminer le taux d’avancement final de la réaction de l’acide avec l’eau en fonction du de la solution et de la concentration molaire .
- En déduire les valeurs numériques du taux d’avancement final de chacune des réactions associées aux transformations donnant les solutions et . Conclure.
On veut maintenant connaître le comportement des solutions et par rapport à la dilution.
- Décrire le mode opératoire pour préparer avec précision au laboratoire de solution fille diluée fois à partir d’une solution mère.
La mesure du des solutions filles obtenues donne pour l’acide chlorhydrique et pour la solution d’acide éthanoïque.
- Dans la solution obtenue après dilution, dans chaque cas, la concentration des ions oxonium at-elle été divisée par ? Justifier.


